Возможности использования бактериологического исследования при глазных заболеваниях ограничены пределами доступности патологического очага. При расположении его в заднем отрезке глаза получить материал для исследования часто очень Трудно и возможность бактериологической диагностики в таких случаях, естественно, исключается. Основная область применения бактериологической диагностики в глазной практике — это заболевания наружного отдела глаза, а также проникающие ранения, при которых материал для исследования может быть получен во время хирургической обработки раны или при извлечении инородного тела. Вообще надо заметить, что при оперативных вмешательствах круг возможностей для получения бактериологического материала значительно расширяется.
Получение материала для исследования
Для получения материала из конъюнктивального мешка пользуются платиновой петлей (при ее отсутствии можно использовать петлю, изготовленную из нити спирали электроплитки, или другой инструмент (стеклянная палочка, шпатель и т. п.), которую предварительно стерилизуют прокаливанием в пламени спиртовой горелки. Оттянув нижнее веко, остывшей петлей захватывают комочек конъюнктивального отделяемого из глубины нижнего свода. При этом необходимо избегать прикосновения петли к коже и краям век, чтобы не занести в материал постороннюю микрофлору. Брать материал желательно до начала лечения и в утренние часы, когда отделяемое бывает более обильным. При отсутствии слизи и гноя (например, при исследовании здоровой конъюнктивы перед операциями) следует использовать слезную жидкость или слегка поскоблить поверхность соединительной оболочки (по Линднеру). Но лучше в таких случаях применить методику Элыннига: впустить в конъюнктивальный мешок из пастеровской пипетки одну каплю стерильного физиологического раствора или бульона и через несколько секунд отсосать эту каплю.
По тем же общим правилам получают материал из слезного мешка, выдавливая его содержимое, и с края века при язвенном блефарите, сняв предварительно корочку с язвы.
Большая осторожность требуется при взятии материала с роговой оболочки, особенно при наличии ползучей язвы роговицы. Петлю (или другой тупой инструмент) следует направлять косо к поверхности язвы и брать материал из прогрессирующего края ее. При этом необходима анестезия (3 капли 1% дикаина) и фиксация глазного яблока.
В качестве материала для исследования при проникающих ранениях глаза можно использовать отделяемое раны (если оно имеется), захватив его петлей или марлевым тампоном, пунктат передней камеры или извлеченное инородное тело, которое помещают в стерильную пробирку с 1-2 мл физиологического раствора. После встряхивания пробирки раствор используют для исследования.
Из передней камеры материал для исследования может быть получен с режущего инструмента во время парацентеза или посредством пункции. После анестезии роговицы (3 капли 1% раствора дикаина) и фиксации глазного яблока косо у лимба вкалывают иглу шприца, вводят ее в переднюю камеру (осторожно, не ранить радужную оболочку и капсулу хрусталика!) и отсасывают 0,3 мл содержимого передней камеры.
При эндофтальмите может возникнуть потребность в получении материала из стекловидного тела. Пункция глазного яблока проводится после анестезии (1 мл 2% раствора новокаина под конъюнктиву) острой и с достаточно широким просветом иглой, вкалываемой ближе к экватору. Отсасывается 0,3-0,5 мл внутриглазного содержимого.
Полученный материал подвергается изучению с целью выявления микроба и определения его вида (микробиологический диагноз). Материал может изучаться:
- на предметном стекле (бактериоскопический метод);
- в посевах (собственно бактериологический метод);
- в эксперименте на животном (биологический метод).
Бактериоскопический метод
может быть использован в условиях любого глазного стационара при наличии несложного лабораторного оборудования и некоторых реактивов.
Для этого необходимо иметь следующее:
- металлическую петлю;
- чистые предметные стекла (на чистом стекле капля воды расплывается, а не принимает шаровидную форму);
- ванночку с подставками для предметных стекол (стеклянные палочки или толстая медная проволока);
- дистиллированную воду;
- спирт;
- пинцет;
- фильтровальную бумагу;
- раствор Люголя (йода 1 г, йодистого калия 2 г, дистиллированной воды 300 мл);
- растворы красок (лучше в склянках, закрытых пипетками с резиновыми баллончиками).
Для очистки новые стекла кипятят в 1% растворе соды (можно использовать золу), а затем промывают водой, слабой соляной кислотой и вновь водой. Стекла, бывшие в употреблении, помещают на 1-2 часа в серную кислоту, после чего кипятят в растворе соды, промывают водой и опускают в 96° спирт. Хранят стекла либо в спирте, либо, вытерев спирт, сухими, в банках с притертой пробкой.
Наиболее употребительные краски: карболовый фуксин Циля (фуксина основного 1 г, кристаллической карболовой кислоты 5 г, спирта 96° 10 мл, глицерина — несколько капель, дистиллированной воды 100 мл). Для окраски фуксин Циля обычно разводят дистиллированной водой в 10 раз (разведенный, или водный фуксин). Метиленовая синька (метиленовой синьки 10 г, спирта 96° 100 мл). Из нее готовят щелочную синьку Леффлера (спиртового раствора синьки 30 мл, 1% калийной или натриевой щелочи 1 мл, дистиллированной воды 100 мл). Карболовый генцианвиолет (готовится так же, как карболовый фуксин Циля).
Микробов изучают либо в живом виде (способы «раздавленной» и «висячей» капли), либо убитыми (в окрашенном препарате). Исследование в живом виде в основном выявляет способность микробов к активному движению, тогда как окрашенные препараты позволяют хорошо изучить их морфологию.
Различают простые способы окраски, когда обычно употребляется одна краска, и сложные способы окраски, выявляющие некоторые особенности физико-химического строения микробной клетки и имеющие поэтому дифференциально-диагностическое значение.
Техника приготовления окрашенных препаратов сводится к следующему. Материал наносят на чистое предметное стекло и равномерно распределяют по поверхности в виде кружка или овала. Мазок должен быть достаточно тонким. При наличии густого гноя следует предварительно нанести на предметное стекло одну каплю дистиллированной воды и размешать материал в этой капле. Мазок высушивают на воздухе. Стекло с высушенным препаратом берут за края большим и указательным пальцами мазком кверху и фиксируют троекратным проведением через пламя спиртовой горелки (на границе светлой и темной его части). При достаточной фиксации ощущается легкое жжение в пальцах. Зафиксированный мазок окрашивают. Готовят несколько препаратов, по меньшей мере два, один из которых окрашивают простым способом (метиленовая синька Леффлера, разведенный фуксин Циля), другой — по способу Грама.
Окрашивание по Леффлеру:
- на мазок кладут кусочек фильтровальной бумаги и наливают раствор синьки Леффлера на 3-5 минут;
- препарат промывают дистиллированной водой и высушивают.
Окрашивание по Граму:
- на мазок кладут кусочек фильтровальной бумаги, на который наливают раствор генцианвиолета на 1-2 минуты;
- сливают краску, снимают бумажку и, не промывая водой, наливают яа препарат люголевский раствор на 1 минуту; при этом мазок чернеет;
- сливают люголевский раствор и обесцвечивают мазок спиртом (лучше путем погружения препарата в стаканчик со спиртом до прекращения отхождения фиолетовых струек);
- тщательно промывают водой;
- заливают мазок разведенным фуксином на 1-2 минуты;
- сливают краску, промывают препарат водой и высушивают.
Удобный способ Грама в модификации Синева, который предложил пользоваться заранее приготовленными кусочками фильтровальной бумаги, пропитанной раствором генцианвиолета и высушенной. На мазок предварительно наносят 2-3 капли воды и затем кладут эти кусочки бумаги. Дальше поступают, как описано выше.
Микроскопию мазков производят с иммерсионным объективом. При окраске по Леффлеру все микробы окрашиваются в синий цвет; при окраске по Граму — либо в сине-фиолетовый (грамположительные микробы), либо в красный цвет (грамотрицательные микробы).
Ограниченное число микробов, участвующих в заболеваниях наружного отдела глаза, и их характерные морфологические признаки нередко позволяют поставить правильный микробиологический диагноз уже с помощью одного только бактериоскопического исследования.
Бактериологический метод
становится необходимым в тех случаях, когда изучение в мазках оказывается недостаточным для установления вида микроба или возникает потребность в определении чувствительности выделенного возбудителя к антибактериальным препаратам.
Отсылая за подробным ознакомлением с бактериологическим методом к специальным руководствам по микробиологии, остановимся здесь лишь на принципах этого метода. Первый этап работы сводится к выделению отдельных видов микробов, т. е. к получению чистых культур. Для этого прибегают к механическому разобщению материала при посеве и к использованию сред, наиболее пригодных для развития предполагаемых возбудителей (элективные среды). Путем пересева отдельных колоний, выросших на среде, получают чистую культуру, которую исследуют под микроскопом (готовят мазки) и пересевают на дифференциально-диагностические среды для изучения биохимических свойств возбудителя.
Высокая требовательность большинства патогенных для глаза микробов в условиях культивирования обусловила преимущественное применение для их выделения элективных сред, содержащих нативный белок. Таковы, например, среда Эльшнига (одна часть лошадиной сыворотки или асцитической жидкости и две части бульона), свернутая сыворотка Леффлера (три части сыворотки и одна часть бульона с 1% пептона, 0,5% NaCl и 1% виноградного сахара), кровяной агар Левенталя (агар и 5-10% дефибринированной крови).
Что касается определения чувствительности микробов к антибиотикам, то наиболее простой способ такого определения заключается в использовании специально изготовляемых промышленностью дисков из фильтровальной бумаги, пропитанных растворами антибиотиков и высушенных в вакууме. Материал для исследования (гной, пунктат, извлеченное инородное тело) помещают в стерильную пробирку с физиологическим раствором (1,5-2 мл). После встряхивания жидкость выливают в чашки Петри, лучше в две — одну с сахарным, другую с кровяным агаром — и покачиванием равномерно распределяют по поверхности среды. Затем на поверхность агара накладывают диски с различными антибиотиками на расстоянии 2 см друг от друга и от края чашек. Чашки ставят в термостат (37°) и на следующий день по величине зоны задержки роста вокруг дисков судят о степени чувствительности микроба к испытуемым антибиотикам. Отсутствие зоны задержки роста указывает на нечувствительность микроба к данному антибиотику.
Биологический метод
в глазной практике применяется только в тех случаях, когда при затрудненной диагностике токсигенное свойство может оказаться решающим в определении вида микроба (например, при дифференциальной диагностике дифтерийной палочки и палочки ксероза).
Лабораторная диагностика вирусных заболеваний глаза
В настоящее время специальное изучение вирусов, в том числе вируса трахомы (рис. 77), осуществляется с помощью культивирования их в культурах тканей (куриный эмбрион, асцит-карцинома мышей и др.) и электронной микроскопии.
Рис. 77. Клеточные включения при трахоме.
В клинической практике для диагностики трахомы применяется метод цитологического изучения соскоба конъюнктивы на наличие или отсутствие телец (включений) Провачека—Гальберштедтера. Для этого тупым скальпелем или краем предметного стекла соскабливают эпителиальный покров конъюнктивы (без крови), который наносят тонким слоем на предметное стекло, в течение 5 минут подсушивают на воздухе и фиксируют путем опускания на 15-20 минут в стаканчик с метиловым спиртом или смесью Никифорова (этиловый эфир и абсолютный спирт в равном количестве). Окраску производят в течение 3-4 часов свежеприготовленным раствором краски Романовского—Гимза (из расчета одна капля краски на 1 мл дистиллированной воды). Затем препарат промывают текучей водой, подсушивают на воздухе и исследуют под микроскопом. При этом ядра эпителиальных клеток оказываются окрашенными в розовый цвет, протоплазма — в светло-синий, включения — в синий, сине-фиолетовый цвет (рис. 77). Последние представляются в виде кокковидных образований, расположенных среди мелкозернистой массы, и признаются носителями трахоматозного вируса. Они чаще обнаруживаются в свежих случаях нелеченой трахомы, но могут встречаться и при паратрахомных конъюнктивитах.
Исследования последних лет выявили новую форму контагиозного вирусного заболевания глаз — эпидемический кератоконъюнктивит, а цитологическое изучение конъюнктивального соскоба при этом заболевании позволило обнаружить в эпителиальных клетках своеобразные включения, совершенно отличные от телец Прсвачека (Б. Л. Поляк, Н. В. Плошинская).
Одним из самых достоверных методов исследования, который проводится в лабораториях больниц и поликлиник является бактериологический. Это достаточно сложный, но очень важный анализ, по которому ученые могут точно сказать, каким возбудителем вызвано недомогание.
Чаще всего простой обыватель встречается с таким понятием, как бакпосев. По сути, это просто одна из составляющих бактериологического метода.
Бактериологический метод исследования представляет собой взятие у человека биологического материала с целью его дальнейшего исследования, причем исследоваться будет материал на наличие в нем определенных бактерий. Для этого, собранное содержимое пробирок будет помещено в специальные среды, в которых бактерии будут «выращиваться». И по тому, где есть рост и размножение, и будет определен источник инфекции.
Такой тип исследования распространен в сфере инфекционных заболеваний, когда для выбора правильного лечения необходимо точно знать возбудителя, так как некоторые бактерии устойчивы даже к самым сильным антибиотикам широкого спектра действия.
К тому же, такой тип исследования применяется многими санитарно — эпидемиологическими проверками на предприятиях общественного питания для того, чтобы предупредить распространение того или иного заболевания.
На сегодняшний день бактериологический метод, или как проще сказать бакпосев, используется часто, причем главная задача специалиста состоит в том, чтобы взять у человека материал до того момента, пока ему не начнут проводить противомикробную терапию.
![]() Микробиология это одна из тех точных наук, которая не терпит ошибок. Именно поэтому не так-то просто стать микробиологом. Нужна усидчивость, внимательность, а также сила воли, потому что нередко приходится сидеть месяцами над одним и тем же материалом, чтобы получить хоть какой-то результат.
Микробиология это одна из тех точных наук, которая не терпит ошибок. Именно поэтому не так-то просто стать микробиологом. Нужна усидчивость, внимательность, а также сила воли, потому что нередко приходится сидеть месяцами над одним и тем же материалом, чтобы получить хоть какой-то результат.
Бактериологический метод исследования в микробиологии важен потому, что позволяет изучить бактерии, понаблюдать за ними в благоприятной для них среде, а также изучить реакцию на тот или иной препарат.
К тому же, благодаря исследованию бактерий на сегодняшний день стало возможным определить, какой возбудитель вызывает то или иное заболевание, и спасти множество жизней. Именно поэтому этот метод занимает такое важное место в микробиологии.
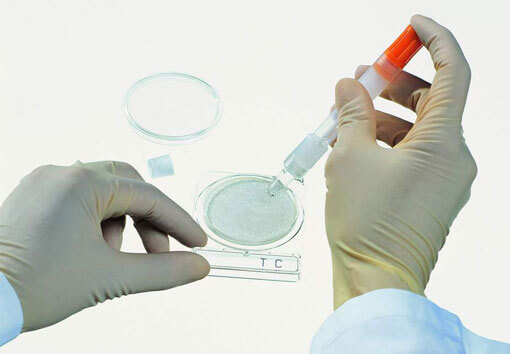
Забор материала для анализов
Для того чтобы получить максимально достоверные результаты, работнику лаборатории или медицинской сестре необходимо соблюсти все гигиенические процедуры, а также хорошо простерилизовать инструмент. И только после этого можно брать образцы.
Чаще всего у человека берут материалы для бактериологического исследования:
- Кал. Обычно такой анализ назначается, если у человека имеются все симптомы кишечной инфекции. Сделать это необходимо, потому что практически все бактерии, попавшие в организм, оказывают разрушительное действие, да и не каждый антибиотики способен положительно воздействовать на все типы возбудителей.
- Слизь из носоглотки и зева. Чаще всего анализы из носоглотки и зева берутся в случае частой ангины, а также надолго затянувшего насморка, потому что в большинстве случаев если такое случается, то возбудитель оказывается намного серьезнее, чем предполагают врачи до получения результатов.
- Мокрота их бронхов. Если у человека воспаление легких, то его точно направят на сдачу этого анализа.
- Моча. Моча у пациента для бактериологического в случае подозрения на инфекцию мочеполовой системы.
- Спинномозговая жидкость. Иногда пациенты поступают в больницу с параличом конечностей, но при этом никаких симптомов других болезней у него нет, то есть с мозговой активностью все в порядке, с проводимостью по нервным окончаниям тоже. Здесь причина может крыться в проникновении инфекции в спинной мозг. Именно поэтом, чтобы как можно быстрее выяснить причину, необходимо взять посев.
- Содержимое очагов воспаления.
- Содержимое кисты.
Больше информации об анализе «посев на флору» можно узнать из видео.
Именно благодаря этим материалам из человеческого организма можно провести точное исследование и выявить проблему. Правда, несмотря на множество достижений в микробиологии, бактериологический посев делает не так быстро.
Сроки получения результатов
Несмотря на то, что всем специалистам хочется получить анализы как можно быстрее, да и часто нет времени просто сидеть и ждать, существуют определенные сроки, по истечении которых можно получить результаты исследования.
В микробиологии существуют четкие временные рамки, которые выглядят примерно так:
- Если был взят кал на анализ, то результата можно получить уже через пять дней. В худшем случае дело может затянуться до недели. Но уже на пятые сутки врачи примерно могут скатать о возбудителе.
- Если были взяты анализы из носоглотки, то в среднем через шесть дней уже будут готовы результаты.
- Если бы взят анализ на , то тут придется подождать десять дней, так как анализ очень объемный и для его проведения требуется намного больше времени.
- Если необходимо выяснить флору организма, то придется подождать от четырех до семи дней, в зависимости от того, как будут проявлять себя бактерии.
- Если был взят анализ урогенитального тракта, то точные результаты будут готовы через неделю, то есть 7 суток.
В том случае, если анализы берутся у пациента, который находится в стационаре, то его лечащий врач уже сможет узнать результаты примерно на четвертые или пятые сутки, так как чаще всего лаборатория расположена непосредственно в больнице.
А вот если анализы сдаются в простой муниципальной поликлинике, то нужно быть готовым к задержкам. Для того чтобы как можно быстрее получить результаты, и чтобы они были как можно достовернее, лучше обратится в одну из лабораторий в городе напрямую. Каждая из них оказывает услуги на платной основе.
 Как и любой другое исследование, бактериологический метод включает в себя несколько этапов, каждый из которых не менее важен, чем предыдущий.
Как и любой другое исследование, бактериологический метод включает в себя несколько этапов, каждый из которых не менее важен, чем предыдущий.
Первый этап включает в себя:
- Подготовка. Необходимо правильно взять исследуемый материал, довезти его до лаборатории, а также при необходимости обработать.
- Обогащение. Такая процедура проводится только в том случае, если количества бактерий в полученном материале не хватает. Чаще всего это происходит с кровью. В этом случае, часть крови помещают в теплое место в такую температуру, которая сподвигнет бактерии к размножению.
- Микроскопия. После того, как все вышеперечисленные процедуры проведены, необходимо исследовать материал под микроскопом для того, чтобы определить микрофлору, количество, а также основные свойства.
- Создание колоний. После того, как под микроскопом были выявлены различные микрофлоры, каждую из них отделяют и помещают в специальную емкость.
Второй этап включает в себя:
- Изучение свойств колоний. Данная процедура включает в себя изучение поведения бактерий, насколько быстро они размножаются, как приспосабливаются и т.д. В том случае, если в одной колонии образовалось еще несколько других, то необходимо изучить свойства каждой.
- Чистая культура. Здесь каждую из колоний помещают в специально определенную под нее емкость и наблюдают за тем, что произойдет дальше.
Третий этап включает в себя:
- Измерение уровня роста и чистоты культуры. В зависимости от того, насколько быстро произошло размножение, а также, не появились ли из этой другие культуры, можно определить семейство бактерий. Так, по цвету окрашивания раствора ученые точно могут сказать о том, как бактерия оказывает разрушительные действия в организме.
- Проверка на антибиотики. После того, как специалист точно смог определить тип культуры, он должен проверить ее на реакцию на те или иные антибиотики.
Бактериологический метод исследования достаточно сложный процесс, который требует сосредоточенности и терпения. Именно поэтому не все люди, получающие медицинское образование, хотят стать микробиологами.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter , чтобы сообщить нам.
Бактериологический метод заключается в выделении чистой культуры возбудителя (популяции, содержащей бактерии одного вида) и идентификации этого возбудителя является основным методом бактериологического исследования
Изучение свойств микроорганизмов в бактериологической лаборатории с целью установления принадлежности к той или иной систематической группе (виду, роду) и называется их идентификация.
В целом бактериологический метод исследования представляет собой многоэтапное бактериологическое исследование, которое длится 18— 24 часов.
Бактериологический метод — как проводят?
При бактериологическом методе в анаэростат помещают посевы анаэробов. Из аэростата удаляют воздух и заменяют его газовой смесью, которая не содержит кислород.
Основой бактериологического метода является выделение чистой культуры возбудителя, которое происходит на первом этапе исследования. Для выделения чистой культуры возбудителя делают посев взятого материала. Посев делается, как правило, на плотные питательные среды, которые выбирают исходя из свойств предполагаемого возбудителя.
При бактериологическом методе применяют по возможности среды, на которых растет только конкретный вид бактерий — элективные среды, или среды, позволяющие отличить предполагаемого возбудителя от других микроорганизмов или по-другому дифференциально-диагностические среды.
Например, при бактериологической диагностике кишечных инфекций — среду Эндо, для выделения дифтерийной палочки используют теллуритовые среды, и т. д. При выделении условно-патогенных микроорганизмов при бактериологическом методе посев взятого материала осуществляют на универсальные питательные среды. Примером такой среды может служить кровяной агар.
Все манипуляции, которые связанны с выделением бактериальных культур, проводятся над пламенем горелки.
При бактериологическом методе посев материала на питательные среды производят либо стеклянным или металлическим шпателем, либо бактериальной петлей таким образом, чтобы находящиеся в исследуемом материале бактерии рассеять по поверхности питательной среды. В результате такого рассеивания каждая бактериальная клетка попадает на свой участок среды.
При выделении из патологического материала чистой культуры возбудителя, который существенно загрязнен посторонней микрофлорой, часто пользуются биологическим методом выделения чистой культуры. Делают это следующим образом: заражают исследуемым материалом чувствительных к возбудителю лабораторных животных. Еще один пример биологического метода — при исследовании больного на содержание в мокроте пневмококков, материал внутрибрюшинно вводят белым мышам. Из их крови через 4-6 часов получают чистую культуру пневмококка.
В том случае, если в результате бактериологического метода исследования предполагается в исследуемом материале содержание малого количества возбудителя, посев производят на жидкую питательную среду для его накопления, так называемую среду обогащения, которая оптимальна для данного микроорганизма. Далее осуществляют пересев из жидкой питательной среды на плотные среды, разлитые в чашках Петри. Засеянную возбудителем среду помещают в термостат обычно при определенной температуре, что важно для бактериологического метода.
На втором этапе бактериологического метода исследования проводят изучение колоний бактерий, выросших на плотной питательной среде и происходящих от одной бактериальной клетки. (колония и является чистой культурой возбудителя). Производят микроскопическое и макроскопическое исследование колоний в отраженном и проходящем свете: невооруженным глазом, под малым увеличением микроскопа, с помощью лупы.
Отмечают культуральные свойства колоний: их форму, величину, цвет, характер краев и поверхности, структуру, консистенцию. Далее для приготовления мазков используют часть каждой из намеченных колоний. Окрашивают мазки по Граму, микроскопируют, определяя тинкториальные (отношение к окраске) и морфологические свойства выделенной культуры и проверяя одновременно ее чистоту.
Оставшуюся часть колонии пересевают в пробирки с оптимальной для данного вида средой, например, скошенным агаром, с целью накопления чистой культуры для более полного ее изучения. Пробирки перемещают на 18-24 часа в термостат. На втором этапе, кроме перечисленных исследований, нередко подсчитывают количество выросших колоний.
Это имеет особенное значение при заболеваниях, вызванных условно-патогенными микроорганизмами. При таких заболеваниях судить о ведущей роли какого-либо возбудителя допустимо лишь по его содержанию в патологическом материале в достаточно большом количестве и преобладанию этого возбудителя над другой флорой.
Для того чтобы провести такое исследование готовят последовательные разведения взятого исследуемого материала, из которых на чашки с питательной средой производят высев, подсчитывают количество выросших колоний, умножают на разведение, из чего определяют содержание микроорганизмов в материале.
Идентификация выделенной чистой культуры возбудителя и определение для этой культуры чувствительности к антибиотикам и другим химиотерапевтическим препаратам — третий этап бактериологичестого метода. Идентификацию выделенной бактериальной культуры производят по тинкториальным, морфологическим, биохимическим, культуральным, токсигенным, антигенным свойствам.
Первым делом берут мазок из культуры, выросшей на скошенном агаре, исследуют морфологию бактерий и проверяют чистоту культуры выросших бактерий. Далее осуществляют посев выделенной чистой культуры бактерий на среды Гисса. Желательно провести посев и на другие среды для определения биохимических свойств.
Ферментативные, или биохимические, свойства бактерий обусловлены ферментами, которые участвуют в расщеплении белков, углеводов, вызывающими восстановление и окисление различных субстратов.
Причем каждый из видов бактерий производит постоянный для него набор ферментов. Чаще всего при изучении антигенных свойств используют реакцию агглютинации на стекле.
С помощью реакции нейтрализации токсина антитоксином in vivo или in vitro определяют токсинообразование микробов. В ряде случаев изучают и другие факторы вирулентности. Вышеперечисленные исследования, которые проводятся в бактериологической лаборатории, позволяют определить род или вид возбудителя.
В том числе для обнаружения источника инфекции, с целью выявления эпидемической цепочки заболевания, осуществляют внутривидовую идентификацию бактерий. Суть внутривидовой идентификации бактерий заключается в определении фаговара или фаготипа, изучении различных свойств выделенных антигенных бактерий. Процесс определения фаготипа называют фаготипирование. Фаготипирование осуществляют при брюшном тифе, стафилококковой инфекции, паратифе В.
На чашку с питательной средой, которая засеяна с помощью шпателя выделенной чистой культурой, наносят различные диагностические фаги по капле. В случае, если культура чувствительна к данному фагу, в результате бактериологического исследования наблюдаются так называемые негативные колонии (бляшки), которые выглядят как образования округлой формы участков разрушенных бактерий. Культура возбудителя может быть чувствительна к нескольким или одному фагам.
В связи с широким распространением лекарственно-устойчивых форм бактерий, для назначения рациональной химиотерапии необходимо определение антибиотикограммы — устойчивости или чувствительности к химиотерапевтическим препаратам выделенной чистой культуры возбудителя. Для антибиотикограммы используют либо метод бумажных дисков, либо наиболее точный, но громоздкий метод серийных разведений.
Метод бумажных дисков базируется на выявлении зоны подавления размножения бактерий вокруг дисков, которые пропитаны антибиотиками. В случае применения метода серийных разведений химический препарат — антибиотик с жидкой питательной средой разводят в пробирках, после чего засеивают в пробирки одинаковое количество бактерий. По отсутствию или наличию роста бактерий проводят учет результатов. В результате бактериологического метода исследования для определения идентичности штаммов, полученная антибиотикограмма может служить и эпидемиологическим целям.
Могут проводиться повторные исследования при выявлении бактерионосительства т. к. можно не обнаружить возбудителя в одной порции материала.
В настоящее время в современном мире существуют ускоренные методы определения вида и рода бактерий. Так, в России применяют систему индикаторных бумажек — СИБ, позволяющую через 6-12 часов и без использования большого числа питательных сред выделить чистую бактериальную культуру. Также широко используют иммунофлюоресцентный метод для экспресс-диагностики инфекционных болезней (см. Серологические исследования).
Бактериологический метод исследования (БЛМИ) – метод, основанный на выделении чистых культур бактерий с помощью культивирования на питательных средах и их идентификации до вида на основании изучения морфологических, культуральных, биохимических, генетических, серологических, биологических, экологических характеристик микроорганизмов.
Бактериологическую диагностику инфекций проводят, используя стандартные диагностические схемы, утвержденные Министерством здравоохранения.
Чистая культура – бактерии одного вида, выращенные на питательной среде, свойства которых находятся в процессе изучения.
Штамм – идентифицированная чистая культура микроорганизмов одного вида, выделенная из определенного источника в определенное время. Штаммы одного вида могут несущественно отличаться биохимическими, генетическими, серологическими, биологическими и др. свойствами, а также местом и временем выделения.
Цели БЛМИ:
1. Постановка этиологического диагноза: выделение чистой культуры микроорганизмов и её идентификация.
2. Определение дополнительных свойств, например, чувствительности микроорганизма к антибиотикам и бактериофагам.
3. Определение количества микроорганизмов (важно в диагностике инфекций, вызываемых УПМ).
4. Типирование микроорганизмов, т. е. определение внутривидовых различий на основании изучения генетических и эпидемиологических (фаговаров и сероваров) маркёров. Это используется в эпидемиологических целях, т. к. позволяет установить общность микроорганизмов, выделяемых от разных больных и из разных объектов внешней среды, в различных стационарах, географических регионах.
БЛМИ включает несколько этапов, различных для аэробов, факультативных анаэробов и облигатных анаэробов.
I. Этапы БЛМИ при выделении чистой культуры аэробов и факультативных анаэробов.
Этап.
А.Забор, транспортировка, хранение, предварительная обработка материала. Иногда до посева проводят селективную обработку материала с учетом свойств выделяемого микроорганизма. Например, перед исследованием мокроты или другого материала на присутствие кислотустойчивых микобактерий туберкулеза, материал обрабатывают растворами кислот или щелочей.
Б. Посев в среду обогащения (при необходимости).Его проводят, если в исследуемом материале содержится малое количество бактерий, например, при выделении гемокультуры. Для этого кровь, взятую на высоте лихорадки в большом объёме (8–10 мл у взрослых, 4–5 мл у детей) засевают в среду в соотношении 1:10 (для преодоления действия бактерицидных факторов крови); посев инкубируют при температуре 37 0 С 18-24 ч.
В. Микроскопия исследуемого материала. Из исследуемого материала готовят мазок, окрашивают его по Граму или другим методом и микроскопируют. Оценивают присутствующую микрофлору, ее количество. В ходе дальнейших исследований должны быть выделены микроорганизмы, присутствовавшие в первичном мазке.
Г. Посев на питательные среды с целью получения изолированных колоний. Производят посев материала петлёй или шпателем методом механического разобщения на чашку с дифференциально-диагностической или селективной средой с целью получения изолированных колоний. После посева чашку переворачивают дном кверху (чтобы избежать размазывания колоний капельками конденсационной жидкости), подписывают и помещают в термостат при температуре 37 0 С на 18-24 ч.
Следует помнить, что при посевах и пересевах микробных культур внимание работающего должно быть обращено на соблюдение правил асептики для предупреждения контаминации питательных сред и предупреждения заражения окружающих и самозаражения!
В случае инфекций, вызываемых условно-патогенными микроорганизмами, где имеет значение количество присутствующих микроорганизмов в патологическом материале, делают количественный посев материала, для чего предварительного готовят ряд 100-кратных разведений материала (обычно 3 разведения) в стерильном изотоническом растворе хлорида натрия в пробирках. После чего по 50 мкл каждого разведения высевают на питательные среды в чашках Петри.
Этап.
А. Изучение морфотипов колоний на средах, их микроскопия. Просматривают чашки и отмечают оптимальную питательную среду, скорость роста, характер роста микроорганизмов. Для изучения выбираютизолированные колонии, расположенные по ходу штриха, ближе к центру. Если вырастает несколько типов колоний – каждый исследуется в отдельности. Оценивают признаки колоний (табл. 7). При необходимости чашки с посевамипросматривают через лупу или с помощью микроскопа с объективом малого увеличения и суженной диафрагмой. Изучают тинкториальные свойства отличающихся морфотипов колоний, для этого из части исследуемой колонии готовят мазок, окрашивают по Граму или другими методами, микроскопируют и определяют морфологию чистоту культуры.При необходимости ставят ориентировочную РА на стекле с поливалентными сыворотками.
Б. Накопление чистой культуры. Для накопления чистой культуры изолированные колонии всех морфотипов пересевают в отдельные пробирки со скошенным агаром или какой-либо другой питательной средой и инкубируют в термостате при +37 0 С (такая температура оптимальна для большинства микроорганизмов, но может быть и другой, например, для Campylobacterium spp. – +42 0 C, Candida spp. и Yersinia pestis – +25 0 C).
В качестве среды накопления для энтеробактерий обычно используют среду Клиглера.
Состав среды Клиглера: МПА, 0,1% глюкозы, 1% лактозы, реактив на сероводород (сернокислое железо + тиосульфат натрия + сульфит натрия), индикатор феноловый красный. Изначальный цвет среды малиново-красный, среда «скошена» в пробирках: имеет столбик (2/3) и скошенную поверхность (1/3).
Посев в среду Клиглера производится штрихом по поверхности и уколом в столбик.
Этап.
А. Учет роста на среде накопления, оценка чистоты культуры в мазке по Граму.Отмечают характер роста выделенной чистой культуры. Визуально чистая культура характеризуется однородным ростом. При микроскопическом исследовании окрашенного мазка, приготовленного из такой культуры, в нём в разных полях зрения обнаруживаются морфологически и тинкториально однородные клетки. Однако в случае выраженного плеоморфизма, присущего некоторым видам бактерий, в мазках из чистой культуры могут встречаться одновременно клетки с различной морфологией.
Если в качестве среды накопления использовали индикаторную среду Клиглера, то оценивают изменения ее цвета в столбике и скошенной части, по которым определяют биохимические свойства: ферментацию глюкозы, лактозы и продукцию сероводорода. При разложении лактозы желтеет скошенная часть среды, при разложении глюкозы – желтеет столбик. При образовании CO 2 в процессе разложения сахаров образуются газовые пузырьки или разрыв столбика. В случае продукции сероводорода отмечается почернение по ходу укола из-за превращении сульфата железа в сульфид железа.
Характер изменения цвета среды Клиглера (рис. 23) объясняется неодинаковой интенсивностью расщепления микроорганизмами азотистых веществ и образования щелочных продуктов в аэробных (на скошенной поверхности) и анаэробных (в столбике) условиях.
В аэробных условиях на скошенной поверхности происходит более интенсивное щелочеобразование, чем в столбике среды. Поэтому при разложении глюкозы, присутствующей в среде в небольшом количестве, образующаяся на скошенной поверхности кислота быстро нейтрализуется. В то же время при разложении лактозы, присутствующей в среде в высокой концентрации, щелочные продукты не способны нейтрализовать кислоту.
В анаэробных условиях в столбике щелочные продукты образуются в ничтожном количестве, поэтому здесь выявляется ферментация глюкозы.
Рис. 23. Индикаторная среда Клиглера:
1 – исходная,
2 – с ростом E. coli,
3– с ростом S. paratyphi B,
4 –с ростом S. typhi
E. coli разлагают глюкозу и лактозу с газообразованием, не продуцируют сероводород. Они вызывают пожелтение столбика и скошенной части с разрывами среды.
S. paratyphi разлагают глюкозу с газообразованием, лактозоотрицательны. Они вызывают пожелтение столбика с разрывами, скошенная часть не изменяет цвет и остается малиновой. При этом S. paratyphi B продуцируют сероводород (по ходу укола появляется черная окраска), S. paratyphi A сероводород не продуцируют.
S. typhi разлагают глюкозу без газообразования, лактозоотрицательны, продуцируют сероводород. Они вызывают пожелтение столбика без разрывов, скошенная часть не изменяет цвет и остается малиновой, по ходу укола появляется черная окраска.
Shigella spp. глюкозопозитивны, лактозоотрицательны, не продуцируют сероводород. Они вызывают пожелтение столбика (с разрывами или без них в зависимости от серовара), скошенная часть не изменяет цвет и остается малиновой.
Б. Окончательная идентификация чистой культуры (определение систематического положения выделенного микроорганизма до уровня вида или варианта) и определение спектра чувствительности выделенной культуры к антибиотикам.
Для идентификации чистой культуры на этом этапе изучают биохимические, генетические, серологические и биологические признаки (табл. 8).
В рутинной лабораторной практике при идентификации нет необходимости изучать все свойства. Используютинформативные, доступные, простые тесты, достаточные для определения видовой (вариантной) принадлежности выделенного микроорганизма.
26. Бактериологический метод диагностики инфекционных заболеваний.
Бактериологический метод заключается в выделении чистой культуры возбудителя (популяции, содержащей бактерии одного вида) и идентификации этого возбудителя является основным методом бактериологического исследования
Изучение свойств микроорганизмов в бактериологической лаборатории с целью установления принадлежности к той или иной систематической группе (виду, роду) и называется их идентификация.
В целом бактериологический метод исследования представляет собой многоэтапное бактериологическое исследование, которое длится 18- 24 часов.
При бактериологическом методе в анаэростат помещают посевы анаэробов. Из аэростата удаляют воздух и заменяют его газовой смесью, которая не содержит кислород.
Основой бактериологического метода является выделение чистой культуры возбудителя, которое происходит на первом этапе исследования. Для выделения чистой культуры возбудителя делают посев взятого материала. Посев делается, как правило, на плотные питательные среды, которые выбирают исходя из свойств предполагаемого возбудителя.
При бактериологическом методе применяют по возможности среды, на которых растет только конкретный вид бактерий - элективные среды, или среды, позволяющие отличить предполагаемого возбудителя от других микроорганизмов или по-другому дифференциально-диагностические среды.
При бактериологическом методе посев материала на питательные среды производят либо стеклянным или металлическим шпателем, либо бактериальной петлей таким образом, чтобы находящиеся в исследуемом материале бактерии рассеять по поверхности питательной среды. В результате такого рассеивания каждая бактериальная клетка попадает на свой участок среды.
В том случае, если в результате бактериологического метода исследования предполагается в исследуемом материале содержание малого количества возбудителя, посев производят на жидкую питательную среду для его накопления, так называемую среду обогащения, которая оптимальна для данного микроорганизма. Далее осуществляют пересев из жидкой питательной среды на плотные среды, разлитые в чашках Петри. Засеянную возбудителем среду помещают в термостат обычно при определенной температуре, что важно для бактериологического метода.
На втором этапе бактериологического метода исследования проводят изучение колоний бактерий, выросших на плотной питательной среде и происходящих от одной бактериальной клетки. (колония и является чистой культурой возбудителя). Производят микроскопическое и макроскопическое исследование колоний в отраженном и проходящем свете: невооруженным глазом, под малым увеличением микроскопа, с помощью лупы.
Отмечают культуральные свойства колоний: их форму, величину, цвет, характер краев и поверхности, структуру, консистенцию. Далее для приготовления мазков используют часть каждой из намеченных колоний. Окрашивают мазки по Граму, микроскопируют, определяя тинкториальные (отношение к окраске) и морфологические свойства выделенной культуры и проверяя одновременно ее чистоту.
Оставшуюся часть колонии пересевают в пробирки с оптимальной для данного вида средой, например, скошенным агаром, с целью накопления чистой культуры для более полного ее изучения. Пробирки перемещают на 18–24 часа в термостат. На втором этапе, кроме перечисленных исследований, нередко подсчитывают количество выросших колоний.
Для того чтобы провести такое исследование готовят последовательные разведения взятого исследуемого материала, из которых на чашки с питательной средой производят высев, подсчитывают количество выросших колоний, умножают на разведение, из чего определяют содержание микроорганизмов в материале.
Идентификация выделенной чистой культуры возбудителя и определение для этой культуры чувствительности к антибиотикам и другим химиотерапевтическим препаратам - третий этап бактериологичестого метода. Идентификацию выделенной бактериальной культуры производят по тинкториальным, морфологическим, биохимическим, культуральным, токсигенным, антигенным свойствам.
Первым делом берут мазок из культуры, выросшей на скошенном агаре, исследуют морфологию бактерий и проверяют чистоту культуры выросших бактерий. Далее осуществляют посев выделенной чистой культуры бактерий на среды Гисса. Желательно провести посев и на другие среды для определения биохимических свойств.
С помощью реакции нейтрализации токсина антитоксином in vivo или in vitro определяют токсинообразование микробов. В ряде случаев изучают и другие факторы вирулентности. Вышеперечисленные исследования, которые проводятся в бактериологической лаборатории, позволяют определить род или вид возбудителя.
Метод бумажных дисков базируется на выявлении зоны подавления размножения бактерий вокруг дисков, которые пропитаны антибиотиками. В случае применения метода серийных разведений химический препарат - антибиотик с жидкой питательной средой разводят в пробирках, после чего засеивают в пробирки одинаковое количество бактерий. По отсутствию или наличию роста бактерий проводят учет результатов. В результате бактериологического метода исследования для определения идентичности штаммов, полученная антибиотикограмма может служить и эпидемиологическим целям.
Могут проводиться повторные исследования при выявлении бактерионосительства т. к. можно не обнаружить возбудителя в одной порции материала.