3.3. Синтез жиров
Синтезируются жиры из глицерина и жирных кислот. Глицерин в организме возникает при распаде жира (пищевого или собственного), а также легко образуется из углеводов. Жирные кислоты синтезируются из ацетилкофермента А - универсального метаболита организма. Для этого синтеза еще необходимы водород (в форме НАДФН 2) и энергия АТФ. В организме синтезируются только насыщенные и мононенасыщенные (имеющие одну двойную связь) жирные кислоты. Кислоты, содержащие две и более двойных связей в своей молекуле (полиненасыщенные), в организме не синтезируются и должны поступать с пищей. Для синтеза жира также могут быть использованы жирные кислоты - продукты гидролиза пищевого и собственного жиров.
Все участники синтеза жира должны быть в активном виде: глицерин в форме глицерофосфата, а жирные кислоты в форме ацилко-фермента А. Синтез жира осуществляется в цитоплазме клеток (преимущественно жировой ткани, печени, тонкой кишки) и протекает по следующей схеме
Следует подчеркнуть, что глицерин и жирные кислоты могут быть получены углеводов. Поэтому при избыточном потреблении углеводов на фоне малоподвижного образа жизни развивается ожирение.
Лекция 4. Обмен белков
4.1. Катаболизм белков
Белки, входящие в состав клеток организма, также подвергаются постоянному распаду под влиянием внутриклеточных протеолитических ферментов, называемых внутриклеточными протеиназами или катепсинами. Эти ферменты локализованы в специальных внутриклеточных органоидах – лизосомах. Под действием катепсинов белки организма также превращаются в аминокислоты. (Важно отметить, что распад как пищевых, так и собственных белков организма приводит к образованию одних и тех же 20 видов аминокислот.) В сутки расщепляется примерно 200 г белков организма. Поэтому в течение суток в организме появляется около 300 г свободных аминокислот.
4.2. Синтез белков
Большая часть аминокислот используется для синтеза белков. Синтез белков происходит при обязательном участии нуклеиновых кислот.
Первый этап синтеза белка - транскрипция - осуществляется в клеточном ядре с использованием ДНК как источника генетической информации. Генетическая информация обусловливает порядок расположения аминокислот в полипептидных цепях синтезируемого белка. Эта информация закодирована последовательностью азотистых оснований в молекуле ДНК. Каждая аминокислота кодируется сочетанием трех азотистых оснований, называемым кодоном , или триплетом . Участок молекулы ДНК, содержащий информацию об определенном белке, получил название «ген». На этом участке ДНК во время транскрипции по принципу комплементарности синтезируется информационная РНК (иРНК). Эта нуклеиновая кислота представляет собой копию соответствующего гена. Образовавшаяся иРНК выходит из ядра и поступает в цитоплазму. Аналогичным образом на ДНК как на матрице происходит синтез рибосомных (рРНК) и транспортных (тРНК).
В ходе второго этапа – рекогниции (распознавания), протекающего в цитоплазме, аминокислоты избирательно связываются со своими переносчиками - транспортными РНК(тРНК). Молекула каждой тРНК представляет собой короткую полинуклеотидную цепь, содержащую примерно 80 нуклеотидов и частично закрученную в двойную спираль, что приводит к возникновению конфигурации «изогнутого клеверного листа». На одном конце полинуклеотидной цепи у всех тРНК находится нуклеотид, содержащий аденин. К этому концу молекулы тРНК присоединяется аминокислота. Петля, противоположная месту присоединения аминокислоты, содержит антикодон, состоящий из трех азотистых оснований и предназначенный для последующего связывания с комплементарным кодоном иРНК. Одна из боковых петель молекулы тРНК обеспечивает присоединение тРНК к ферменту, участвующему в рекогниции , а другая, боковая, петля необходима для присоединения тРНК к рибосоме на следующем этапе синтеза белка.
На этом этапе в качестве источника энергии используется молекула АТФ. В результате рекогниции образуется комплекс аминокислота-тРНК. В связи с этим второй этап синтеза белка называют активацией аминокислот.
Третий этап синтеза белка - трансляция - происходит на рибосомах. Каждая рибосома состоит из двух частей - большой и малой субчастиц. По химическому составу обе субчастицы состоят из рРНК и белков. Рибосомы способны легко распадаться на субчастицы, которые снова могут соединяться друг с другом, образуя рибосому. Трансляция начинается с диссоциации рибосомы на субчастицы, которые сразу же присоединяются к начальной части молекулы иРНК, поступающей из ядра. При этом между субчастицами остается пространство (так называемый туннель), где располагается небольшой участок иРНК. Затем к образовавшемуся комплексу рибосома - иРНК присоединяются тРНК, связанные с аминокислотами. Присоединение тРНК к этому комплексу происходит путем связывания одной из боковых петлей тРНК с рибосомой и связывания антикодона тРНК с комплементарным ему кодоном иРНК, находящимся в туннеле между субчастицами рибосомы. Одновременно к комплексу рибосома - иРНК могут присоединиться только две тРНК с аминокислотами.
Благодаря специфическому связыванию антикодонов тРНК с кодонами иРНК, к участку молекулы иРНК, находящемуся в туннеле, присоединяются только молекулы тех тРНК, у которых антикодоны комплементарны кодонам иРНК. Поэтому эти тРНК доставляют в рибосомы только строго определенные аминокислоты. Далее аминокислоты соединяются друг с другом пептидной связью и образуется дипептид, который связан с одной из тРНК. После этого рибосома передвигается вдоль иРНК ровно на один кодон (это перемещение рибосомы называется траислокацией ).
В результате транслокации свободная (без аминокислоты) тРНК отщепляется от рибосомы, а в зоне туннеля появляется новый кодон, к которому присоединяется по принципу комплементарности еще одна тРНК с аминокислотой, соответствующей этому кодону. Доставленная аминокислота соединяется с ранее образовавшимся дипептидом, что приводит к удлинению пептидной цепи. Далее следуют новые транслокации, поступление на рибосому новых тРНК с аминокислотами и дальнейшее удлинение пептидной цепи.
Таким образом порядок включения аминокислот в синтезируемый белок определяется последовательностью кодонов в иРНК. Завершается синтез полипептидной цепи при поступлении в туннель особого кодона, который не кодирует аминокислоты и к которому не может присоединиться ни одна тРНК. Такие кодоны называются терминирующими.
В итоге за счет описанных трех этапов синтезируются полипептиды, т. е. формируется первичная структура белка. Высшие (пространственные) структуры (вторичная, третичная, четвертичная) возникают самопроизвольно.
Синтез белков - процесс энергоемкий. Для включения в молекулу синтезируемого белка только одной аминокислоты требуется не менее трех молекул АТФ.
4.3. Метаболизм аминокислот
Помимо синтеза белков аминокислоты еще используются для синтеза различных небелковых соединений, имеющих важное биологическое значение. Часть аминокислот подвергается распаду и превращается в конечные продукты: С0 2 , Н 2 0 и NН 3 Распад начинается с реакций, общих для большинства аминокислот.
К ним относятся:
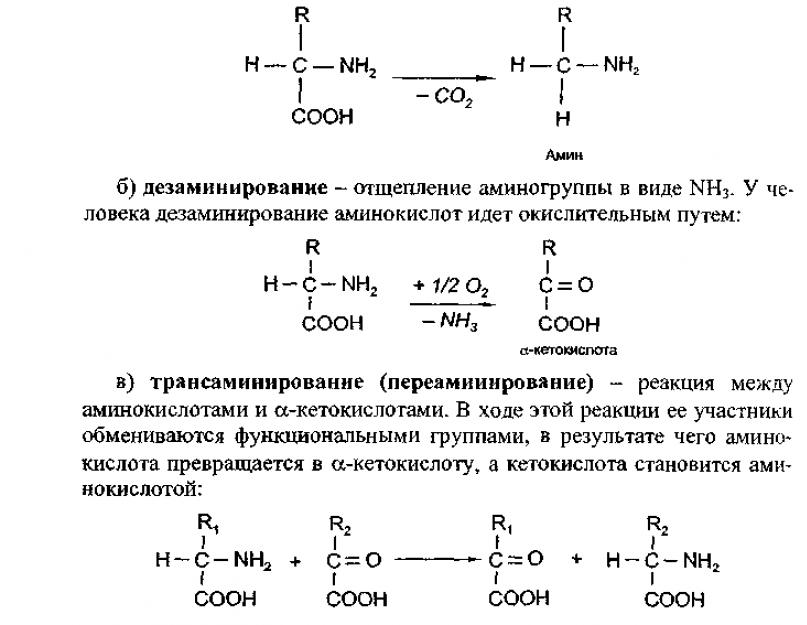
а) декарбоксилирование - отщепление от аминокислот карбоксильной группы в виде углекислого газа:

Трансаминированию подвергаются все аминокислоты. В этой реакции участвует кофермент - фосфопиридоксаль, для образования которого необходим витамин В 6 - пиридоксин.
Трансаминирование - это главное превращение аминокислот в организме, так как его скорость значительно выше, чем у реакций декар-боксилирования и дезаминирования.
Трансаминирование выполняет две основные функции:
а) за счет трансаминирования одни аминокислоты могут превращаться в другие. При этом общее количество аминокислот не меняется, но изменяется соотношение между ними. С пищей в организм посту пают чужеродные белки, у которых аминокислоты находятся в иных пропорциях по сравнению с белками организма. Путем трансаминирования происходит корректировка аминокислотного состава организма.
б) является составной частью косвенного (непрямого) дезаминирования аминокислот - процесса, с которого начинается распад большинства аминокислот.
На первой стадии этого процесса аминокислоты вступают в реакцию трансаминирования с α-кетоглутаровой кислотой. Аминокислоты при этом превращаются в α-кетокислоты, а α-кетоглутаровая кислота переходит в глутаминовую кислоту (аминокислота).
На второй стадии появившаяся глутаминовая кислота подвергается дезаминированию, от нее отщепляется NН 3 и снова образуется α-кетоглутаровая кислота. Образовавшиеся α-кетокислоты далее подвергаются глубокому распаду и превращаются в конечные продукты С0 2 и Н 2 0. Для каждой из 20 кетокислоr (их образуется столько же, сколько имеется видов аминокислот) имеются свои специфические пути распада. Однако при распаде некоторых аминокислот в качестве промежуточного продукта образуется пировиноградная кислота, из которой возможен синтез глюкозы. Поэтому аминокислоты, из которых возникают такие кетокислоты, получили название глюкогенные. Другие же кетокислоты при своем распаде не образуют пирувата. Промежуточным продуктом у них является ацетилкофермент А, из которого невозможно получить глюкозу, но зато могут синтезироваться кетоновые тела. Аминокислоты, соответствующие таким кетокислотам, называются кетогенные.
Второй продукт косвенного дезаминирования аминокислот - аммиак. Для организма аммиак является высокотоксичным. Поэтому в организме имеются молекулярные механизмы его обезвреживания. По мере образования NН 3 связывается во всех тканях с глутаминовой кислотой с образованием глутамина. Это временное обезвреживание аммиака. С током крови глутамин поступает в печень, где распадается опять на глутаминовую кислоту и NНз. Образовавшаяся глутаминовая кислота с кровью снова поступает в органы для обезвреживания новых порций аммиака. Освободившийся аммиак, а также углекислый газ в печени используются для синтеза мочевины.
Синтез мочевины - циклический, многостадийный процесс, потребляющий большое количество энергии. В синтезе мочевины очень важное участие принимает аминокислота орнитин. Эта аминокислота не входит в состав белков. Образуется орнитин из другой аминокислоты - аргинина, который присутствует в белках. В связи с важной ролью орнитина синтез мочевины получил название орнитиновый цикл.
Впроцессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в аргинин, от которого сразу же отщепляется мочевина, и вновь образуется орнитин. Наряду с орнитином и аргинином в образовании мочевины еще участвуют аминокислоты: глутамин и аспарагиновая кислота. Глутамин является поставщиком аммиака, а аспарагиновая кислота его переносчиком.
Синтез мочевины - это окончательное обезвреживание аммиака. Из печени с кровью мочевина поступает в почки и выделяется с мочой. В сутки образуется 20-35 г мочевины. Выделение мочевины с мочой характеризует скорость распада белков в организме.
Раздел 3. Биохимия мышечной ткани
Лекция 5. Биохимия мышц
5.1. Клеточное строение мышечного волокна
У животных и человека имеются два основных типа мышц: поперечно-полосатые и гладкие. Поперечно-полосатые мышцы прикрепляются к костям, т. е. к скелету, и поэтому еще называются скелетными. Поперечно-полосатые мышечные волокна составляют также основу сердечной мышцы – миокарда, хотя имеются определенные различия в строении миокарда и скелетных мышц. Гладкие мышцы образуют мускулатуру стенок кровеносных сосудов, кишечника, пронизывают ткани внутренних органов и кожу.
Каждая поперечно-полосатая мышца состоит из нескольких тысяч волокон, объединенных соединительнотканными прослойками и такой же оболочкой - фасцией. Мышечные волокна (миоциты) представляют собою сильно вытянутые многоядерные клетки крупного размера длиной до 2-3 см, а в некоторых мышцах даже более 10 см. Толщина мышечных клеток около 0,1-0,2 мм.
Как и любая клетка, миоцит содержит такие обязательные органоиды, как ядра, митохондрии, рибосомы, цитоплазматическую сеть и клеточную оболочку. Особенностью миоцитов, отличающих их от других клеток, является наличие сократительных элементов - миофибрилл.
Ядра окружены оболочкой - нуклеолеммой и состоят в основном из нуклеопротеидов. В ядре содержится генетическая информация для синтеза белков.
Рибосомы - внутриклеточные образования, являющиеся по химическому составу нуклеопротеидами. На рибосомах происходит синтез белков.
Митохондрии - микроскопические пузырьки размером до 2-3 мкм, окруженные двойной мембраной. В митохондриях протекает окисление углеводов, жиров и аминокислот до углекислого газа и воды с использованием молекулярного кислорода (кислорода воздуха). За счет энергии, выделяющейся при окислении, в митохондриях осуществляется синтез АТФ. В тренированных мышцах митохондрии многочисленны и располагаются вдоль миофибрилл.
Цитоплазматическая сеть (саркоплазматическая сеть, саркоплаз-матический ретикулум) состоит из трубочек, канальцев и пузырьков, образованных мембранами и соединенных друг с другом. Саркоплазматическая сеть с помощью особых трубочек, называемых Т-системой, связана с оболочкой мышечной клетки - сарколеммой. Особо следует выделить в саркоплазматической сети пузырьки, называемые цистер нами и содержащие в большой концентрации ионы кальция. В цистернах содержание ионов Са 2+ примерно в тысячу раз выше, чем в цитозоле. Такой высокий градиент концентрации ионов кальция возникает вследствие функционирования фермента - кальциевой аденозинтри-фосфатазы (кальциевая АТФаза), встроенного в стенку цистерны. Этот фермент катализирует гидролиз АТФ и за счет выделяющейся при этом энергии обеспечивает перенос ионов кальция вовнутрь цистерн. Такой Механизм транспорта ионов кальция образно называется кальциевым насосом, или кальциевой помпой.
Цитоплазма (цитозоль, саркоплазма) занимает внутреннее пространство миоцитов и представляет собой коллоидный раствор, содержащий белки, гликоген, жировые капли и другие включения. На долю белков саркоплазмы приходится 25-30% от всех белков мышц. Среди саркоплазматических белков имеются активные ферменты. К ним в первую очередь следует отнести ферменты гликолиза, расщепляющие гликоген или глюкозу до пировиноградной или молочной кислоты. Еще один важный фермент саркоплазмы - креатинкиназа , участвующий в энергообеспечении мышечной работы. Особого внимания заслуживает белок саркоплазмы миоглобин, который по строению идентичен одной из субъединиц белка крови – гемоглобина. Состоит миоглобин из одного полипептида и одного гема. Функция миоглобина заключается в связывании молекулярного кислорода. Благодаря этому белку в мышечной ткани создается определенный запас кислорода. В последние годы установлена еще одна функция миоглобина - это перенос 0 2 от сарколеммы к мышечным митохондриям.
Кроме белков в саркоплазме имеются небелковые азотсодержащие вещества. Их называют, в отличие от белков, экстрактивными веществами, так как они легко экстрагируются водой. Среди них - адениловые нуклеотиды АТФ, АДФ, АМФ и другие нуклеотиды, причем преобладает АТФ. Концентрация АТФ в покое примерно 4-5 ммоль/кг. К экстрактивным веществам также относятся креатинфосфат, его предшественник - креатин и продукт необратимого распада креатинфосфата - креатинин. В покое концентрация креатинфосфата обычно 15-25 ммоль/кг. Из аминокислот в большом количестве имеются глутаминовая кислота и глутамин.
Основной углевод мышечной ткани - гликоген. Концентрация гликогена колеблется в пределах 0,2-3%. Свободная глюкоза в саркоплазме содержится в очень малой концентрации - имеются лишь ее следы. В процессе мышечной работы в саркоплазме происходит накопление продуктов углеводного обмена - лактата и пирувата.
Протоплазматический жир связан с белками и имеется в концентрации 1%. Запасной жир накапливается в мышцах, тренируемых на выносливость.
5.2. Структура сарколеммы
Каждое мышечное волокно окружено клеточной оболочкой - сарколеммой. Сарколемма представляет собою лилопротеидную мембрану толщиной около 10 нм. Снаружи сарколемма окружена сетью из переплетенных нитей белка коллагена. При мышечном сокращении в коллагеновой оболочке возникают упругие силы, за счет которых при расслаблении мышечное волокно растягивается и возвращается в исходное состояние. К сарколемме подходят окончания двигательных нервов. Место контакта нервного окончания с сарколеммой называется нервно-мышечный синапс, или концевая нервная пластинка.
Сократительные элементы - миофибриллы - занимают большую часть объема мышечных клеток, их диаметр около 1 мкм. В нетренированных мышцах миофибриллы расположены рассеянно, а в тренированных они сгруппированы в пучки, называемые полями Конгейма.
5.3. Строение анизотропных и изотропных дисков
Микроскопическое изучение строения миофибрилл показало, что они состоят из чередующихся светлых и темных участков, или дисков. В мышечных клетках миофибриллы располагаются таким образом, что светлые и темные участки рядом расположенных миофибрилл совпадают, что создает видимую под микроскопом поперечную исчерченность всего мышечного волокна. Было обнаружено, что миофибриллы являются сложными структурами, построенными, в свою очередь, из большого числа мышечных нитей (протофибрилл, или филаментов) двух типов - толстых и тонких. Толстые нити имеют диаметр 15 нм, тонкие - 7 нм.
Состоят же миофибриллы из чередующихся пучков параллельно расположенных толстых и тонких нитей, которые концами заходят друг в друга. Участок миофибриллы, состоящий из толстых нитей и находящихся между ними концов тонких нитей, обладает двойным лучепреломлением. При микроскопии этот участок задерживает видимый свет или поток электронов (при использовании электронного микроскопа) и поэтому кажется темным. Такие участки получили название анизотропные, или темные, диски (А-диски).
Светлые участки миофибрилл состоят из центральных частей тонких нитей. Они сравнительно легко пропускают лучи света или поток электронов, так как не обладают двойным лучепреломлением и называются изотропными, или светлыми, дисками (I -диски). В середине пучка тонких нитей поперечно располагается тонкая пластинка из белка, которая фиксирует положение мышечных нитей в пространстве. Эта пластинка хорошо видна под микроскопом в виде линии, идущей поперек I-диска, и названа Z -пластинкой.
Участок миофибриллы между соседними 2-линиями получил название саркомер. Его длина 2,5-3 мкм. Каждая миофибрилла состоит из нескольких сотен саркомеров (до 1000).
5.4. Строение и свойства сократительных белков
Изучение химического состава миофибрилл показало, что толстые и тонкие нити состоят только из белков.
Толстые нити состоят из белка миозина. Миозин - белок с молекулярной массой около 500 кДа, содержащий две очень длинные полипептидные цепи. Эти цепи образуют двойную спираль, но на одном конце эти нити расходятся и формируют шаровидное образование - глобулярную головку. Поэтому в молекуле миозина различают две части - глобулярную головку и хвост. В состав толстой нити входит около 300 миозиновых молекул, а на поперечном срезе толстой нити обнаруживается 18 молекул миозина. Миозиновые молекулы в толстых нитях переплетаются своими хвостами, а их головки выступают из толстой нити по правильной спирали. В головках миозина имеются два важных участка (центра). Один из них катализирует гидролитическое расщепление АТФ, т. е. соответствует активному центру фермента. АТФазная активность миозина впервые обнаружена отечественными биохимиками Энгельгардтом и Любимовой. Второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей - ак тином.
Тонкие нити состоят из трех белков: актина, тропонина и тропо миозина.
Основной белок тонких нитей - актин. Актин - глобулярный белок с молекулярной массой 42 кДа. Этот белок обладает двумя важнейшими свойствами. Во-первых, проявляет высокую способность к полимеризации с образованием длинных цепей, называемых фибриллярным актином (можно сравнить с нитью бус). Во-вторых, как уже отмечалось, актин может соединяться с миозиновыми головками, что приводит к образованию между тонкими и толстыми нитями поперечных мостиков, или спаек.
Основой тонкой нити является двойная спираль из двух цепей фибриллярного актина, содержащая около 300 молекул глобулярного актина (как бы две нити бус, закрученные в двойную спираль, каждая бусинка соответствует глобулярному актину).
Еще один белок тонких нитей – тропомиозин – также имеет форму двойной спирали, но эта спираль образована полипептидными цепями и по размеру гораздо меньше двойной спирали актина. Тропомиозин располагается в желобке двойной спирали фибриллярного актина.
Третий белок тонких нитей – тропонин - присоединяется к тропомиозину и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей.
5.5. Механизм мышечного сокращения
Мышечное сокращение является сложным механохимическим процессом, в ходе которого происходит преобразование химической энергии гидролитического расщепления АТФ в механическую работу, совершаемую мышцей.
В настоящее время этот механизм еще полностью не раскрыт. Но достоверно известно следующее:
Источником энергии, необходимой для мышечной работы является АТФ.
Гидролиз АТФ, сопровождающийся выделением энергии, катализируется миозином, который, как уже отмечалось, обладает ферментативной активностью.
Пусковым механизмом мышечного сокращения является повышение концентрации ионов Са в саркоплазме миоцитов, вызываемое двигательным нервным импульсом.
Во время мышечного сокращения между толстыми и тонкими нитями миофибрилл возникают поперечные мостики, или спайки.
Во время мышечного сокращения происходит скольжение тонких нитей вдоль толстых, что приводит к укорочению миофибрилл и всего мышечного волокна в целом.
Имеется много гипотез, пытающихся объяснить молекулярный механизм мышечного сокращения. Наиболее обоснованной в настоящее время является гипотеза «весельной лодки », или «гребная» гипотеза X. Хаксли. В упрощенном виде ее суть заключается в следующем.
В мышце, находящейся в состоянии покоя, толстые и тонкие нити миофибрилл друг с другом не соединены, так как участки связывания на молекулах актина закрыты молекулами тропомиозина.
Мышечное сокращение происходит под воздействием двигательного нервного импульса, представляющего собой волну повышенной мембранной проницаемости, распространяющуюся по нервному волокну.
Эта волна повышенной проницаемости передается через нервно-мышечный синапс на Т-систему саркоплазматической сети и в конечном счете достигает цистерн, содержащих ионы кальция в большой концентрации. В результате значительного повышения проницаемости стенки цистерн ионы кальция выходят из цистерн и их концентрация в саркоплазме за очень короткое время (около 3 мс) возрастает в 1000 раз. Ионы кальция, находясь в высокой концентрации, присоединяются к белку тонких нитей - тропонину - и меняют его пространственную форму (конформацию). Изменение конформации тропонина, в свою очередь, приводит к тому, что молекулы тропомиозина смещаются вдоль желобка фибриллярного актина, составляющего основу тонких нитей, и освобождают тот участок актиновых молекул, который предназначен для связывания с миозиновыми головками. В результате этого между миозином и актином (т. е. между толстыми и тонкими нитями) возникает поперечный мостик, расположенный под углом 90°. Поскольку в толстые и тонкие нити входит большое число молекул миозина и актина (около 300 в каждую), то между мышечными нитями образуется довольно большое количество поперечных мостиков, или спаек. Образование связи между актином и миозином сопровождается повышением АТФазной активности последнего, в результате чего происходит гидролиз АТФ:
АТФ + Н 2 0 АДФ + Н 3 Р0 4 + энергия
За счет энергии, выделяющейся при расщеплении АТФ, миозиновая головка, подобно шарниру или веслу лодки, поворачивается и мостик между толстыми и тонкими нитями оказывается под углом 45°, что приводит к скольжению мышечных нитей навстречу друг другу. Совершив поворот, мостики между толстыми и тонкими нитями разрываются. АТФазная активность миозина вследствие этого резко снижается, и гидролиз АТФ прекращается. Но если двигательный нервный импульс продолжает поступать в мышцу и в саркоплазме сохраняется высокая концентрация ионов кальция, поперечные мостики вновь образуются, АТФазная активность миозина возрастает и снова происходит гидролиз новых порций АТФ, дающий энергию для поворота поперечных мостиков с последующим их разрывом. Это ведет к дальнейшему движению толстых и тонких нитей навстречу друг другу и укорочению миофибрилл и мышечного волокна.
Учебно -методический комплекс по дисциплине по по биохимии . 2. Следующим...
Учебно-методический комплекс по дисциплине (83)
Учебно-методический комплексКафедры) Ф.и.о. автора_____Родина Елена Юрьевна________________________________ Учебно -методический комплекс по дисциплине МОЛЕКУЛЯРНАЯ БИОЛОГИЯ (название) Специальность... с учебниками по молекулярной биологии указаны учебники по биохимии . 2. Следующим...
В организме человека исходным сырьем для биосинтеза жиров могут служить углеводы, поступающие с пищей, в растениях – сахароза, поступающая из фотосинтезирующих тканей. Например, биосинтез жиров (триацилглицеролов) в созревающих семенах масличных растений также тесно связан с обменом углеводов. На ранних стадиях созревания клетки основных тканей семян – семядолей и эндосперма заполнены крахмальными зернами. Только потом, на более поздних стадиях созревания крахмальные зерна замещаются липидами, основным компонентом которых является триацилглицерол.
Основные этапы синтеза жира включают образование из углеводов глицерол-3-фосфата и жирных кислот, а затем сложноэфирных связей между спиртовыми группами глицерола и карбоксильными группами жирных кислот:
Рисунок 11– Общая схема синтеза жира из углеводов
Рассмотрим более подробно основные этапы синтеза жира из углеводов (см. рис. 12).
Синтез глицерол-3-фосфата
Iэтап – при действии соответствующих гликозидаз углеводы подвергаются гидролизу с образованием моносахаридов (см. п.1.1.), которые в цитоплазме клеток включаются в процесс гликолиза (см. рис. 2). Промежуточными продуктами гликолиза являются фосфодиоксиацетон и 3-фосфоглицериновый альдегид.
IIэтап. Глицерол-3-фосфат образуется в результате восстановления фосфодиоксиацетона – промежуточного продукта гликолиза:

Кроме того, глицеро-3-фосфат может образоваться в ходе темновой фазы фотосинтеза.
Взаимосвязь липидов и углеводов
Синтез жиров из углеводов

Рисунок 12 – Схема превращения углеводов в липиды
Синтез жирных кислот
Строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который образуется двумя путями: либо в результате окислительного декарбоксилирования пирувата. (см. рис. 12, Этап III), либо в результате-окисления жирных кислот (см. рис. 5). Напомним, что превращения образовавшегося при гликолизе пирувата в ацетил-КоА и его образование при-окислении жирных кислот происходит в митохондриях. Синтез жирных кислот протекает в цитоплазме. Внутренняя мембрана митохондрий непроницаема для ацетил-КоА. Его поступление в цитоплазму осуществляется по типу облегченной диффузии в виде цитрата или ацетилкарнитина, которые в цитоплазме превращаются в ацетил-КоА, оксалоацетат или карнитин. Однако главный путь переноса ацетил-коА из митохондрии в цитозоль является цитратный (см. рис. 13).
Вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-КоА и АТФ, вновь распадается на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной дикарбоксилаттранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:

Рисунок 13 – Схема переноса ацетил-КоА из митохондрий в цитозоль
Биосинтез насыщенных жирных кислот происходит в направлении, противоположном их -окислению, наращивание углеводородных цепей жирных кислот осуществляется за счет последовательного присоединения к их концам двухуглеродного фрагмента (С 2) – ацетил-КоА (см. рис. 12, этапIV.).
Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуется СО 2 , АТФ, ионыMn. Катализирует эту реакцию фермент ацетил-КоА – карбоксилаза. Фермент содержит в качестве простетической группы биотин (витамин Н). Реакция протекает в два этапа: 1 – карбоксилирование биотина с участием АТФ иII– перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:

Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Нужно отметить, что скорость биосинтеза жирных кислот определяется содержанием сахаров в клетке. Увеличение концентрации глюкозы в жировой ткани человека, животных и повышение скорости гликолиза стимулирует процесс синтеза жирных кислот. Это свидетельствует о том, что жировой и углеводный обмен тесно взаимосвязаны друг с другом. Важную роль здесь играет именно реакция карбоксилирования ацетил-КоА с его превращением в малонил-КоА, катализируемая ацетил-КоА-карбоксилазой. Активность последней зависит от двух факторов: наличия в цитоплазме высокомолекулярных жирных кислот и цитрата.
Накопление жирных кислот оказывает тормозящее влияние на их биосинтез, т.е. подавляют активность карбоксилазы.
Особая роль отводится цитрату, который является активатором ацетил-КоА-карбоксилазы. Цитрат в то же время играет роль связующего звена углеводного и жирового обменов. В цитоплазме цитрат вызывает двойной эффект в стимулировании синтеза жирных кислот: во-первых, как активатор ацетил-КоА-карбоксилазы и, во-вторых, как источник ацетильных групп.
Очень важной особенностью синтеза жирных кислот является то, что все промежуточные продукты синтеза ковалентно связаны с ацилпереносящим белком (HS-АПБ).
HS-АПБ – низкомолекулярный белок, который термостабилен, содержит активнуюHS-группу и в простетической группе которого содержится пантотеновая кислота (витамин В 3). ФункцияHS-АПБ аналогична функции фермента А (HS-КоА) при-окислении жирных кислот.
В процессе построения цепи жирных кислот промежуточные продукты образуют эфирные связи с АБП (см. рис. 14):

Цикл удлинения цепи жирных кислот включает четыре реакции: 1) конденсации ацетил-АПБ (С 2) с малонил-АПБ (С 3); 2) восстановления; 3) дегидротации и 4) второго восстановления жирных кислот. На рис. 14 представлена схема синтеза жирных кислот. Один цикл удлинения цепи жирной кислоты включает четыре последовательных реакции.

Рисунок 14 – Схема синтеза жирных кислот
В первой реакции (1) – реакции конденсации – ацетильная и малонильные группы взаимодействуют между собой с образованием ацетоацетил-АБП с одновременным выделением СО 2 (С 1). Эту реакцию катализирует конденсирующий фермент-кетоацил-АБП-синтетаза. Отщепленный от малонил-АПБ СО 2 – это тот же самый СО 2 , который принимал участие в реакции карбоксилирования ацетил-АПБ. Таким образом, в результате реакции конденсации происходит образование из двух-(С 2) и трехуглеродных (С 3) компонентов четырехуглеродного соединения (С 4).
Во второй реакции (2) – реакции восстановления, катализируемой -кетоацил-АПБ-редуктазой, ацетоацетил-АПБ превращается в-гидроксибутирил-АПБ. Восстанавливающим агентом служит НАДФН + Н + .
В третьей реакции (3) цикла-дегидратации – от -гидроксибутирил-АПБ отщепляется молекула воды с образованием кротонил-АПБ. Реакция катлизируется-гидроксиацил-АПБ-дегидратазой.
Четвертой (конечный) реакцией (4) цикла является восстановление кротонила-АПБ в бутирил-АПБ. Реакция идет под действием еноил-АПБ-редуктазы. Роль восстановителя здесь выполняет вторая молекула НАДФН + Н + .
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С 16). В этом случае образование бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы молонил-АПБ (3) – реакция (5) к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется карбоксильная группа в виде СО 2 (С 1). Этот процесс можно представить в следующем виде:
С 3 + С 2 С 4 + С 1 – 1цикл
С 4 + С 3 С 6 + С 1 – 2 цикл
С 6 + С 3 С 8 + С 1 –3 цикл
С 8 + С 3 С 10 + С 1 – 4 цикл
С 10 + С 3 С 12 + С 1 – 5 цикл
С 12 + С 3 С 14 + С 1 – 6 цикл
С 14 + С 3 С 16 + С 1 – 7 цикл
Могут синтезироваться не только высшие насыщенные жирные кислоты, но и ненасыщенные. Мононенасыщенные жирные кислоты образуются из насыщенных в результате окисления (десатурации), катализуруемой ацил-КоА-оксигеназой. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные. Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. В организме млекопитающих, в том числе и человека, не могут образовываться, например, из стеариновой кислоты (С 18:0) линолевая (С 18:2) и линоленовая (С 18:3) кислоты. Эти кислоты относятся к категории незаменимых жирных кислот. К незаменимым жирным кислотам относят также арахиновую кислоту (С 20:4).
Наряду с десатурацией жирных кислот (образование двойных связей) происходит и их удлинение (элонгации). Причем, оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН+Н + .
На рисунке 15 представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.

Рисунок 15 – Схема превращения насыщенных жирных кислот
в ненасыщенные
Завершается синтез любой жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:

Образовавшийся ацил-КоА является активной формой жирной кислоты.
Синтезируются жиры из глицерина и жирных кислот.
Глицерин в организме возникает при распаде жира (пищевого и собственного), а также легко образуются из углеводов.
Жирные кислоты синтезируются из ацетилкофермента А. Ацетилкофермент А – универсальный метаболит. Для его синтеза необходимы водород и энергия АТФ. Водород же получается из НАДФ.Н2. В организме синтезируются только насыщенные и мононасыщенные (имеющие одну двойную связь) жирные кислоты. Жирные кислоты, имеющие две и более двойных связей в молекуле, называемые полинасыщенные, в организме не синтезируются и должны поступать с пищей. Для синтеза жира могут быть использованы жирные кислоты – продукты гидролиза пищевого и собственного жиров.
Все участники синтеза жира должны быть в активном виде: глицерин в форме глицерофосфата , а жирные кислоты в формеацетилкофермента А. Синтез жира осуществляется в цитоплазме клеток (преимущественно жировой ткани, печени, тонкой кишки).Пути синтеза жиров представлены в схеме.
Следует отметить, что глицерин и жирные кислоты могут быть получены из углеводов. Поэтому при избыточном потреблении их на фоне малоподвижного образа жизни развивается ожирение.
ДАФ –дигидроацетонфосфат,
ДАГ – диацилглицерин.
ТАГ – триацилглицерол.
Общая характеристика липопротеинов. Липиды в водной среде (а значит, и в крови) нерастворимы, поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками – липопротеины.
Все типы липопротеинов имеют сходное строение – гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами,и амфифильными молекулами липидов – фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
Апопротеины выполняют несколько функций:
Формируют структуру липопротеинов;
Взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов;
Служат ферментами или активаторами ферментов, действующих на липопротеины.
Липопротеины. В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).Каждый из типов ЛП образуется в разных тканях и транспортирует определѐнные липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц.
Свойства липопротеинов. ЛП хорошо растворимы в крови, неопалесцируют, так как имеют небольшойразмер иотрицательный зарядна
поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам. Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой. Судьба жирных кислот, глицерола и остаточных хиломикронов. В результате действия ЛП-липазы на жиры ХМ образуются жирные кислоты и глицерол. Основная масса жирных кислот проникает в ткани. В жировой ткани в абсорбтивный период жирные кислоты депонируются в виде триацилглицеролов, в сердечной мышце и работающих скелетных мышцах используются как источник энергии. Другой продукт гидролиза жиров, глицерол, растворим в крови, транспортируется в печень, где в абсорбтивный период может быть использован для синтеза жиров.
Гиперхиломикронемия, гипертриглицеронемия. После приѐма пищи, содержащей жиры, развивается физиологическая гипертриглицеронемия и, соответственно, гиперхиломикронемия, которая может продолжаться до нескольких часов.Скорость удаления ХМ из кровотока зависит от:
Активности ЛП-липазы;
Присутствия ЛПВП, поставляющих апопротеины С-II и Е для ХМ;
Активности переноса апоС-II и апоЕ на ХМ.
Генетические дефекты любого из белков, участвующих в метаболизме ХМ, приводят к развитию семейной гиперхиломикронемии – гиперлипопротеинемии типа I.
В растениях одного и того же вида состав и свойства жира могут колебаться в зависимости от климатических условий произрастания. Содержание и качество жиров в животном сырье также зависит от породы, возраста, степени упитанности, пола, сезона года и т.д.
Жиры широко используют, при производстве многих пищевых продуктов, они обладают высокой калорийностью и пищевой ценностью, вызывают длительное чувство насыщения. Жиры являются важными вкусовыми и структурными компонентами в процессе приготовления пищевых продуктов, оказывают значительное влияние на внешний вид пищи. При жарке жир играет роль среды, передающей тепло.
|
Название продукта |
Название продукта |
Примерное содержа-ние жиров в пищевых продуктах, % на сырую массу |
|
|
Хлеб ржаной | |||
|
Подсолнечника |
Овощи свежие | ||
|
Плоды свежие | |||
|
Говядина | |||
|
Какао-бобы | |||
|
Орехи арахиса |
Баранина | ||
|
Орехи грецкие (ядра) |
Рыба | ||
|
Хлебные злаки: |
Молоко коровье | ||
|
Масло сливочное | |||
|
Маргарин | |||
В жирах, полученных из растительных и животных тканей, кроме глицеридов, могут находиться свободные жирные кислоты, фосфатиды, стеролы, пигменты, витамины, вкусовые и ароматические вещества, ферменты, белки и др., которые влияют на качество и свойства жиров. На вкус и запах жиров также оказывают влияние вещества, образующиеся в жирах при хранении (альдегиды, кетоны, перекисные и другие соединения).
Жиры в организм человека должны постоянно поступать с пищей. Потребность в жирах зависит от возраста, характера работы, климатических условий и других факторов, но в среднем в сутки взрослому человеку необходимо от 80 до 100 г жиров. В суточном рационе должно быть примерно 70 % животных и 30 % растительных жиров.
Синтезируются жиры из глицерина и жирных кислот.
Глицерин в организме возникает при распаде жира (пищевого и собственного), а также легко образуются из углеводов.
Жирные кислоты синтезируются из ацетилкофермента А. Ацетилкофермент А – универсальный метаболит. Для его синтеза необходимы водород и энергия АТФ. Водород же получается из НАДФ.Н2. В организме синтезируются только насыщенные и мононасыщенные (имеющие одну двойную связь) жирные кислоты. Жирные кислоты, имеющие две и более двойных связей в молекуле, называемые полинасыщенные, в организме не синтезируются и должны поступать с пищей. Для синтеза жира могут быть использованы жирные кислоты – продукты гидролиза пищевого и собственного жиров.
Все участники синтеза жира должны быть в активном виде: глицерин в форме глицерофосфата , а жирные кислоты в форме ацетилкофермента А. Синтез жира осуществляется в цитоплазме клеток (преимущественно жировой ткани, печени, тонкой кишки). Пути синтеза жиров представлены в схеме.
Следует отметить, что глицерин и жирные кислоты могут быть получены из углеводов. Поэтому при избыточном потреблении их на фоне малоподвижного образа жизни развивается ожирение.
ДАФ –дигидроацетонфосфат,
ДАГ – диацилглицерин.
ТАГ – триацилглицерол.
Общая характеристика липопротеинов. Липиды в водной среде (а значит, и в крови) нерастворимы, поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками – липопротеины.
Все типы липопротеинов имеют сходное строение – гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов – фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
Апопротеины выполняют несколько функций:
Формируют структуру липопротеинов;
Взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов;
Служат ферментами или активаторами ферментов, действующих на липопротеины.
Липопротеины. В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).Каждый из типов ЛП образуется в разных тканях и транспортирует определѐнные липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц.
Свойства липопротеинов. ЛП хорошо растворимы в крови, неопалесцируют, так как имеют небольшойразмер и отрицательный заряд на
поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам. Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой. Судьба жирных кислот, глицерола и остаточных хиломикронов. В результате действия ЛП-липазы на жиры ХМ образуются жирные кислоты и глицерол. Основная масса жирных кислот проникает в ткани. В жировой ткани в абсорбтивный период жирные кислоты депонируются в виде триацилглицеролов, в сердечной мышце и работающих скелетных мышцах используются как источник энергии. Другой продукт гидролиза жиров, глицерол, растворим в крови, транспортируется в печень, где в абсорбтивный период может быть использован для синтеза жиров.
Гиперхиломикронемия, гипертриглицеронемия. После приѐма пищи, содержащей жиры, развивается физиологическая гипертриглицеронемия и, соответственно, гиперхиломикронемия, которая может продолжаться до нескольких часов.Скорость удаления ХМ из кровотока зависит от:
Активности ЛП-липазы;
Присутствия ЛПВП, поставляющих апопротеины С-II и Е для ХМ;
Активности переноса апоС-II и апоЕ на ХМ.
Генетические дефекты любого из белков, участвующих в метаболизме ХМ, приводят к развитию семейной гиперхиломикронемии – гиперлипопротеинемии типа I.
В растениях одного и того же вида состав и свойства жира могут колебаться в зависимости от климатических условий произрастания. Содержание и качество жиров в животном сырье также зависит от породы, возраста, степени упитанности, пола, сезона года и т.д.
Жиры широко используют, при производстве многих пищевых продуктов, они обладают высокой калорийностью и пищевой ценностью, вызывают длительное чувство насыщения. Жиры являются важными вкусовыми и структурными компонентами в процессе приготовления пищевых продуктов, оказывают значительное влияние на внешний вид пищи. При жарке жир играет роль среды, передающей тепло.
| Название продукта | Название продукта | Примерное содержа-ние жиров в пищевых продуктах, % на сырую массу | |
| Семена: | Хлеб ржаной | 1,20 | |
| Подсолнечника | 35-55 | Овощи свежие | 0,1-0,5 |
| Конопли | 31-38 | Плоды свежие | 0,2-0,4 |
| Мака | Говядина | 3,8-25,0 | |
| Какао-бобы | Свинина | 6,3-41,3 | |
| Орехи арахиса | 40-55 | Баранина | 5,8-33,6 |
| Орехи грецкие (ядра) | 58-74 | Рыба | 0,4-20 |
| Хлебные злаки: | Молоко коровье | 3,2-4,5 | |
| Пшеница | 2,3 | Масло сливочное | 61,5-82,5 |
| Рожь | 2,0 | Маргарин | 82,5 |
| Овес | 6,2 | Яйца | 12,1 |
В жирах, полученных из растительных и животных тканей, кроме глицеридов, могут находиться свободные жирные кислоты, фосфатиды, стеролы, пигменты, витамины, вкусовые и ароматические вещества, ферменты, белки и др., которые влияют на качество и свойства жиров. На вкус и запах жиров также оказывают влияние вещества, образующиеся в жирах при хранении (альдегиды, кетоны, перекисные и другие соединения).
Процесс синтеза углеводов из жиров можно представить общей схемой:
Рисунок 7 – Общая схема синтеза углеводов из жиров
Один из основных продуктов расщепления липидов – глицерин – легко используется в синтезе углеводов через образование глицеральдегид-3-фосфата и его вступление в глюнеогенез. У растений и микроорганизмов столь же легко используется на синтез углеводов и другой важный продукт расщепления липидов– жирные кислоты (ацетил-КоА), через глиоксилатный цикл.
Но общая схема не отражает всех биохимических процессов, происходящих в результате образования углеводов из жиров.
Поэтому рассмотрим все этапы данного процесса.
Схема синтеза углеводов и жиров более полно представлена на рисунке 8 и происходит в ряд этапов.
1 этап . Гидролитическое расщепление жира под действием фермента липазы на глицерин и высшие жирные кислоты (см. п.1.2). Продукты гидролиза должны, пройдя ряд превращений, превратиться в глюкозу.

Рисунок 8 – Схема биосинтеза углеводов из жиров
2 этап . Превращение высших жирных кислот в глюкозу. Высшие жирные кислоты, которые образовались в результате гидролиза жира, разрушаются преимущественно путем b-окисления (этот процесс был рассмотрен ранее в разделе 1.2 пункт 1.2.2). Окончательным продуктом этого процесса является ацетил-КоА.
Глиоксилатный цикл
Растения, некоторые бактерии и грибы могут использовать ацетил-КоА не только в цикле Кребса, но и в цикле, получившим название глиоксилатного. Этот цикл играет важную роль в качестве связующего звена в метаболизме жиров и углеводов.
Особенно интенсивно глиоксилатный цикл функционирует в особых клеточных органеллах–глиоксисомах – при прорастании семян масличных растений. При этом происходит превращение жира в углеводы, необходимые для развития проростка семени. Этот процесс функционирует до тех пор, пока у проростка не разовьется способность к фотосинтезу. Когда в конце прорастания запасной жир истощается, глиоксисомы в клетке исчезают.
Глиоксилатный путь специфичен только для растений и бактерий, у животных организмов он отсутствует. Возможность функционирования глиоксилатного цикла связана с тем, что растения и бактерии способны синтезировать такие ферменты, как изоцитратлиаза и малатсинтаза, которые вместе с некоторыми ферментами цикла Кребса участвуют в глиоксилатном цикле.
Схема окисления ацетил-КоА по глиоксилатному пути показана на рисунке 9.

Рисунок 9 – Схема глиоксилатного цикла
Две начальные реакции (1 и 2) глиоксилатного цикла идентичны таковым цикла трикарбоновых кислот. В первой реакции (1) ацетил-КоА конденсируется с оксалоацетатом под действием цитратсинтазы, с образованием цитрата. Во второй реакции цитрат изомеризуется в изоцитрат при участии аконитатгидратазы. Следующие реакции, специфичные для глиоксилатного цикла, катализируются специальными ферментами. В третьей реакции изоцитрат под действием изоцитратлиазы расщепляется на глиоксилевую кислоту и янтарную кислоту:

В ходе четвертой реакции, катализируемой малатсинтазой, глиоксилат конденсируется с ацетил-КоА (второй молекулой ацетил-КоА, вступающей в глиоксилатный цикл) с образованием яблочной кислоты (малат):

Затем в пятой реакции малат окисляется до оксалоацетата. Эта реакция идентична конечной реакции цикла трикарбоновых кислот; она же является конечной реакцией глиоксилатного цикла, т.к. образовавшийся оксалоацетат вновь конденсируется с новой молекулой ацетил-КоА, начиная тем самым новый оборот цикла.
Образовавшаяся в третьей реакции глиоксилатного цикла янтарная кислота не используется этим циклом, а подвергается дальнейшим превращениям.