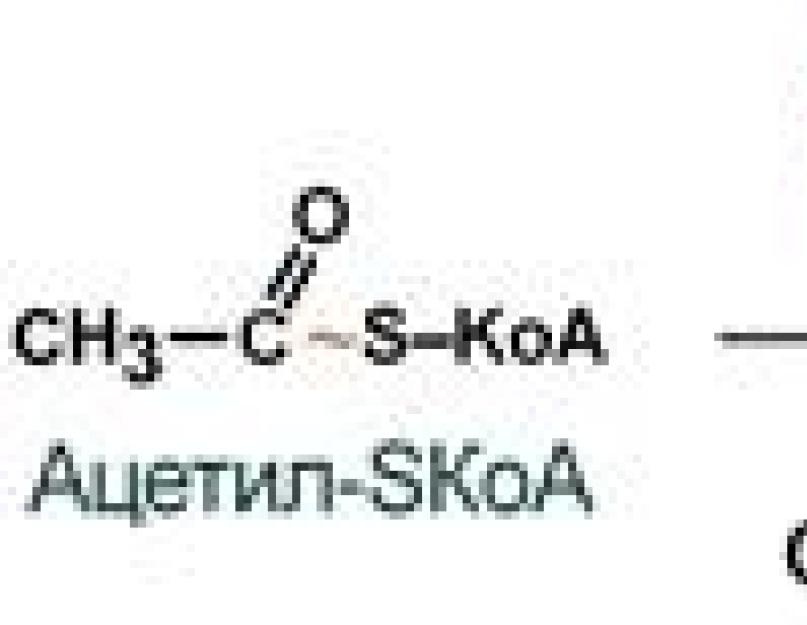Биосинтез жиров
Включает в себя биосинтез жирных кислот и триацилглицеридов (собственно, жиров).
Биосинтез жирных кислот происходит при высокой концентрации глюкозы в крови в основном в печени и в жировой ткани. В этот период активируется гликолиз, в результате которого образуются субстраты для синтеза жирных кислот: ацетил КоА, АТФ, (НАДФ·Н + Н +) и другие. Основным строительным блоком для биосинтеза жирных кислот служит ацетил КоА, а главным конечным продуктом является пальмитиновая кислота С15Н31СООН.
Другие жирные кислоты образуются, как правило, путём модификации молекулы пальмитиновой кислоты – наращиванием цепи и дегидрированием. В последнем случае образуются непредельные кислоты.
Синтез пальмитиновой кислоты происходит не в митохондриях, где происходит катаболизм жирных кислот, а в цитозоле. Основным ферментом этого биосинтеза служит мультиферментный комплекс пальметилсинтетаза . Так как мембрана митохондрии непроницаема для ацетил КоА, то начальным этапом биосинтеза является перенос ацетил КоА через митохондриальную мембрану с помощью цитратпируватного челночного механизма.
Известно, что первой реакцией цикла Кребса является конденсация ацетил КоА с щавелевоуксусной кислотой (оксалоацетатом) с образованием цитрата (лимонной кислоты). Часть образовавшихся цитрат-ионов не вовлекается в дальнейшие реакции цикла Кребса, а переносятся через митохондриальную мембрану в цитозоль, где в присутствии цитратлиазы и при участии АТФ и HS-KoA вновь образует ацетил-КоА и ЩУК:
Цитрат + HS-KoA + АТФ → Оксалоацетат + Ацетил-КоА + АДФ + Н 3 РО 4
Возвращение оксалоацетата в митохондрии осуществляется с помощью двух посредников − малата и пирувата
Восстановление оксалоацетата в малат в цитозоле является частью малатаспартатного челночного механизма переноса восстановленного (НАД∙Н + Н +) из цитозоля в митохондрии:
Оксалоацетат + НАД∙Н + Н + ↔ Малат + НАД
Однако образовавшийся малат не переносится с\через мембрану, а сразу окисляется с одновременным декарбоксилированием в пируват:
Малат + НАДФ + → Пируват + СО 2 + НАДФ∙Н + Н +
Все описанные превращения изображены на схеме:
Таким образом, перенос одной молекулы ацетил КоА из митохондрии в цитозоль сопровождается образованием одной молекулы восстановленной формы (НАДФ·Н + Н +), который необходим для многих биосинтезов, а пируват, который дифундирует в митохондрии, затем карбоксилируется с образованием оксалоацетата.
Собственно синтез пальмитиновой кислоты начинается с карбоксилирования ацетил КоА. Эта реакция протекает в присутствии фермента, простетической группой которого является биотин:
Эта реакция является ключевой в синтезе жирных кислот. Дальнейшие превращения объединяются в циклы по шесть реакций, и в результате завершения каждого цикла углеродная цепь будущей молекулы удлиняется на два углеродных атома.
Рассмотрим реакции, протекающие в первом цикле синтеза жирных кислот.
В первых двух реакциях происходит перенос ацетильного и малонильного фрагментов на ацилпереносящий белок (АПБ).
АПБ представляет собой полипептидную цепь, состоящую из 77 аминокислотных остатков и бокового ответвления, повторяющую по существу структуру кофермента А:
Реакции переноса ацетильного и малонильного фрагментов с ацетил-КоА (1) и малонил-КоА (2) катализируются ацилтрансферазами.
3-ья реакция состоит в образовании ацетоацетил-АПБ из ацетил-АПБ и маонил-АПБ с одновременным декарбоксилированием.
В дальнейшем в три этапа (реакции 4-6) происходит восстановление образовавшегося ацетоацетил-АПБ.
В ходе 4-ой реакции одна из двух карбонильных групп восстанавливается до гидроксильной и образуется дегидроксибутерил-АПБ. Эта реакция является НАДФ–зависимой, т.е. восстановителем служит восстановленная форма НАДФ:
5-ая реакции - реакция дегидратации, ферментом этой реакции является гидроксиацил-АПБ-дегидратаза:
Следующая реакция восстановления (6) – реакция гидрирования – также требует участия НАДФ∙Н + Н + . Катализируется она еноил-АПБ-редуктазой, продуктом реакции являетотся бутирилАПБ:
Все реакции цикла элонгации (удлинения) цепи жирных кислот катализируются мультиферментным комплексом. Он состоит из двух полипептидных цепей. Одна из них (субъединица А) включает АПБ, оксоацил-АПБ-синтазу и оксоацил-редуктазу. В составе субъединицы Б находятся 4 других фермента. Согласованная работа мультиферментного комплекса обусловлена наличием в молекуле АПБ большого рычага – гибкой и достаточно длинной цепочки атомов, соединяющей «якорную» HS-группу с полипептидной цепью
Синтез пальмитиновой кислоты включает 7 циклов. Во второй цикл вместо ацетил-АПБ вступает уже бутирил-АПБ (С 4 -ацил), и в результате образуется каприл-АПБ (С 6 -ацил) и т.д. (схема):
1-ый цикл: малонил-АПБ + ацетил_АПБ
2-ой цикл: малонил-АПБ + бутирил-АПБ
3-ий цикл: малонил-АПБ + каприл-АПБ
4-ый цикл: малонил-АПБ + С 8 -ацил-АПБ
5-ый цикл: малонил-АПБ + С 10 -ацил-АПБ
6-ой цикл: малонил-АПБ + С 12 -ацил-АПБ
7-ой цикл: малонил-АПБ + С 14 -ацил-АПБ
пальмитил-АПБ
Суммарное уравнение биосинтеза пальмитиновой кислоты из ацетил-КоА в результате реакций семи циклов записывается следующим образом:
8 ацетил-Коа + 7 АТФ + 14 (НАДФ∙Н + Н +) → пальмитат + 14 НАДФ +
8 НS-КоА + 7 АДФ + 7 Н 3 РО 4
Из пальмитиновой кислоты путем присоединения дополнительно одной или нескольких молекул ацетил-КоА синтезируюся молекулы с более длинными цепями, а путем дегидрирования – ненасыщенные кислоты. «Доработка» молекул пальмитиновой кислоты осуществляется с помощью ферментов эндоплазматической сети, но может проходить и в митохондриях. Дегидрирование насыщенной жирной кислоты происходит параллельно с окислением НАДФ под действием молекулярного кислорода:
С 15 Н 31 СОО-S-КоА + НАДФ∙Н + Н + + О 2 →СН 3 -(СН 2) 5 -СН=СН-(СН 2) 7 -СОО-S-КоА +НАДФ + + 2 Н 2 О
Дегидрирование насыщенных жирных кислот происходит в клетках печени и жировой ткани. В организме человека отсутствуют ферменты, позволяющие дегидрировать фрагменты –СН 2 -СН 2 -, находящиеся дальше С 9 , поэтому диеновая линолевая кислота
С 18 Н 32 СООН и триеновая линоленовая кислота С 18 Н 30 СООН в организме не синтезируются.
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды .
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-SКоА из митохондрий в цитозоль :
- может быть в комплексе с карнитином , подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении,
- обычно в составе лимонной кислоты , образующейся в первой реакции ЦТК.
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА.
Образование ацетил-SКоА из лимонной кислоты
Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент).
3. Образование малонил-SКоА из ацетил-SКоА.
Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой , мульферментным комплексом из трех ферментов.

Образование малонил-SКоА из ацетил-SКоА
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментным комплексом "синтаза жирных кислот " (синоним пальмитатсинтаза ) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ).
Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза , также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.

Активные группы синтазы жирных кислот
В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы.
3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С 2 малонила с отщеплением карбоксильной группы.
Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза ), дегидратации (дегидратаза ) и опять восстановления (еноил-редуктаза ) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином .
Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы , к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой .

Реакции синтеза жирных кислот
Удлинение цепи жирных кислот
Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С 18 или С 20 .
Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С 20). Но двойная связь животными клетками вводится не далее 9 атома углерода , поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников.
Например, арахидоновая кислота может образоваться в клетке только при наличии линоленовой или линолевой кислот. При этом линолевая кислота (18:2) дегидрируется до γ-линоленовой (18:3) и удлиняется до эйкозотриеновой кислоты (20:3), последняя далее вновь дегидрируется до арахидоновой кислоты (20:4). Так формируются жирные кислоты ω6-ряда
Для образования жирных кислот ω3-ряда, например, тимнодоновой (20:5), необходимо наличие α-линоленовой кислоты (18:3), которая дегидрируется (18:4), удлиняется (20:4) и опять дегидрируется (20:5).
Образование ацетил-КоА и его транспорт в цитозоль
Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы:
Ацетил-КоА + Оксалоацетат -> Цитрат + HS-КоА.
Затем транслоказа переносит цитрат в цитоплазму (рис. 8-35).
Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы:
Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат.
Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот, а окса-лоацетат в цитозоле подвергается следующим превращениям (см. схему ниже).
Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH - окислительные стадии пентозофосфатного пути катаболизма глюкозы.
Образование малонил-КоА из ацетил-КоА - регуляторная реакция в биосинтезе жирных кислот.
Первая реакция синтеза жирных кислот - превращение ацетил-КоА в малонил-КоА. Фермент, катализирующий эту реакцию (ацетил-КоА-карбоксилаза), относят к классу лигаз. Он содержит ковалентно связанный биотин (рис. 8-36). В первой стадии реакции СО 2 ковалентно связывается с биотином за счёт энергии АТФ, во второй стадии СОО - переносится на ацетил-КоА с образованием малонил-КоА. Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот.
Реакции, катализируемые синтазой жирных кислот, - ферментным комплексом, катализирующим реакции синтеза пальмитиновой кислоты, описывается ниже.
После образования малонил-КоА синтез жирных кислот продолжается на мультиферментном комплексе - синтазе жирных кислот (пальмитоилсинтетазе). Этот фермент состоит из 2 идентичных протомеров, каждый из которых имеет доменное строение и, соответственно, 7 центров, обладающих разными каталитическими активностями (рис. 8-37). Этот комплекс последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит ма-лонил-КоА. Конечный продукт работы этого комплекса - пальмитиновая кислота, поэтому прежнее название этого фермента - пальмитоилсинтетаза.
Первая реакция - перенос ацетильной группы ацетил-КоА на тиоловую группу цистеина ацетилтрансацилазным центром (рис. 8-38). Затем от малонил-КоА остаток малонила переносится на сульфгидрильную группу ацилпереносящего белка малонилтрансацилазным центром. После этого комплекс готов к первому циклу синтеза.
Ацетильная группа конденсируется с остатком малонила по месту отделившегося СО 2 . Реакция катализируется кетоацилсинтазным центром. Образовавшийся радикал ацетоацетила
Схема

Рис. 8-35. Перенос ацетильных остатков из митохондрий в цитозоль. Действующие ферменты: 1 - цитратсинтаза; 2 - транслоказа; 3 - цитратлиаза; 4 - малатдегидрогеназа; 5 - малик-фермент.

Рис. 8-36. Роль биотина в реакции карбоксилирования ацетил-КоА.

Рис. 8-37. Строение мультиферментного комплекса - синтезы жирных кислот. Комплекс - димер из двух идентичных полипептидных цепей, каждый из которых имеет 7 активных центров и ацилпереносящий белок (АПБ). SH-группы протомеров принадлежат различным радикалам. Одна SH-группа принадлежит цистеину, другая - остатку фосфопантетеиновой кислоты. SH-группа цистеина одного мономера расположена рядом с SH-группой 4-фосфопантетеината другого протомера. Таким образом, протомеры фермента расположены "голова к хвосту". Хотя каждый мономер содержит все каталитические центры, функционально активен комплекс из 2 протомеров. Поэтому реально синтезируются одновременно 2 жирных кислоты. Для упрощения в схемах обычно изображают последовательность реакций при синтезе одной молекулы кислоты.
последовательно восстанавливается кетоацил-редуктазой, затем дегидратируется и опять восстанавливается еноилредуктазой - активными центрами комплекса. В результате первого цикла реакций образуется радикал бутирила, связанный с субъединицей синтазы жирных кислот.
Перед вторым циклом радикал бутирила переносится из позиции 2 в позицию 1 (где находился ацетил в начале первого цикла реакций). Затем остаток бутирила подвергается тем же превращениям и удлиняется на 2 углеродных атома, происходящих из малонил-КоА.
Аналогичные циклы реакций повторяются до тех пор, пока не образуется радикал пальмитиновой кислоты, который под действием тиоэстеразного центра гидролитически отделяется от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту (пальмитат, рис. 8-38, 8-39).
Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид:
CH 3 -CO-SKoA + 7 HOOC-CH 2 -CO-SKoA + 14 (NADPH + H +) → C 15 H 31 COOH + 7 СО 2 + 6 Н 2 О + 8 HSKoA + 14 NADP + .
Основные источники водорода для синтеза жирных кислот
В каждом цикле биосинтеза пальмитиновой кислоты проходят 2 реакции восстановления,

Рис. 8-38. Синтез пальмитиновой кислоты. Синтаза жирных кислот: в первом протомере SH-группа принадлежит цистеину, во втором - фосфопантетеину. После окончания первого цикла радикал бутирила переносится на SH-группу первого протомера. Затем повторяется та же последовательность реакций, что и в первом цикле. Пальмитоил-Е - остаток пальмитиновой кислоты, связанный с синтазой жирных кислот. В синтезированной жирной кислоте только 2 дистальных атома углерода, обозначенные *, происходят из ацетил-КоА, остальные - из малонил-КоА.

Рис. 8-39. Общая схема реакций синтеза пальмитиновой кислоты.
донором водорода в которых служит кофермент NADPH. Восстановление NADP + происходит в реакциях:
дегидрирования в окислительных стадиях пентозофосфатного пути катаболизма глюкозы;
дегидрирования малата малик-ферментом;
дегидрирования изоцитрата цитозольной NADP-зависимой дегидрогеназой.
2. Регуляция синтеза жирных кислот
Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами.
Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента (рис. 8-40).
Фосфорилирование/дефосфорилирование ацетил-КоА-карбоксилазы. В постабсорбтивном состоянии или при физической работе глюкагон или адреналин через аденилатциклазную систему активируют протеинкиназу А и стимулируют фосфорилирование субъединиц ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается. В абсорбтивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние (рис. 8-41). Затем под действием цитрата происходит полимеризация протомеров фермента, и он становится активным. Кроме активации фермента, цитрат выполняет и другую функцию в синтезе жирных кислот. В аб-сорбтивный период в митохондриях клеток печени накапливается цитрат, в составе которого остаток ацетила транспортируется в цитозоль.
Индукция синтеза ферментов. Длительное потребление богатой углеводами и бедной жирами пищи приводит к увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы,

Рис. 8-40. Ассоциация/диссоциация комплексов ацетил-КоА-карбоксилазы.

Рис. 8-41. Регуляция ацетил-КоА-карбоксилазы.
Рис. 8-42. Удлинение пальмитиновой кислоты в ЭР. Радикал пальмитиновой кислоты удлиняется на 2 углеродных атома, донором которых служит малонил-КоА.
изоцитратдегидрогеназы. Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров.
3. Синтез жирных кислот из пальмитиновой кислоты
Удлинение жирных кислот. В ЭР происходит удлинение пальмитиновой кислоты с участием малонил-КоА. Последовательность реакций сходна с той, что происходит при синтезе пальмитиновой кислоты, однако в данном случае жирные кислоты связаны не с синтазой жирных кислот, а с КоА. Ферменты, участвующие в элонгации, могут использовать в качестве субстратов не только пальмитиновую, но и другие жирные кислоты (рис. 8-42), поэтому в организме могут синтезироваться не только стеариновая кислота, но и жирные кислоты с большим числом атомов углерода.
Основной продукт элонгации в печени - стеариновая кислота (С 18:0), однако в ткани мозга образуется большое количество жирных кислот с более длинной цепью - от С 20 до С 24 , которые необходимы для образования сфинголипидов и гликолипидов.
В нервной ткани происходит синтез и других жирных кислот - α-гидроксикислот. Оксидазы со смешанными функциями гидроксилируют С 22 и С 24 кислоты с образованием лигноцериновой и цереброновой кислот, обнаруживаемых только в липидах мозга.
Образование двойных связей в радикалах жирных кислот. Включение двойных связей в радикалы жирных кислот называется десатурацией. Основные жирные кислоты, образующиеся в организме человека в результате десатурации (рис. 8-43), - пальмитоо-леиновая (С16:1Δ9) и олеиновая (С18:1Δ9).
Образование двойных связей в радикалах жирных кислот происходит в ЭР в реакциях с участием молекулярного кислорода, NADH и цитохрома b 5 . Ферменты десатуразы жирных кислот, имеющиеся в организме человека, не могут образовывать двойные связи в радикалах жирных кислот дистальнее девятого атома углерода, т.е. между девятым и

Рис. 8-43. Образование ненасыщенных жирных кислот.
метильным атомами углерода. Поэтому жирные кислоты семейства ω-3 и ω-6 не синтезируются в организме, являются незаменимыми и обязательно должны поступать с пищей, так как выполняют важные регуляторные функции.
Для образования двойной связи в радикале жирной кислоты требуется молекулярный кислород, NADH, цитохром b 5 и FAD-зависимая редуктаза цитохрома b 5 . Атомы водорода, отщепляемые от насыщенной кислоты, выделяются в виде воды. Один атом молекулярного кислорода включается в молекулу воды, а другой также восстанавливается до воды с участием электронов NADH, которые передаются через FADH 2 и цитохром b 5 .
Эйкозаноиды - биологически активные вещества, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов (слово "эйкоза" по гречески означает 20).
Субстратом синтеза ВЖК является ацетил-КоА.Однако,в ходе синтеза жирных кислот (ЖК) в каждом цикле удлинения используется не сам ацетил-КоА, а его производное - малонил-КоА.
Эту реакцию катализирует фермент ацетил-КоА-карбоксилаза -ключевой фермент в мультиферментной системе синтеза ЖК. Активность фермента регулируется по типу отрицательной обратной связи. Ингибитором является продукт синтеза: ацил-КоА с длинной цепью (n=16) - пальмитоил-КоА. Активатором является цитрат. В состав небелковой части этого фермента входит витамин H (биотин).
В дальнейшем в ходе синтеза жирных кислот происходит поэтапное удлинение молекулы ацил-КоА на 2 углеродных атома за каждый этап за счет малонил-КоА, который в этом процессе удлинения теряет СО 2 .
После образования малонил-КоА основные реакции синтеза жирных кислот катализируются одним ферментом - синтетазой жирных кислот (фиксирован на мембранах эндоплазматического ретикулума). Синтетаза жирных кислот содержит 7 активных центров и АПБ (ацилпереносящий белок). Участок, связывающий малонил-КоА, содержит небелковый компонент – витамин B 3 (пантотеновую кислоту). Последовательность одного цикла реакций синтеза ВЖК прпедставлен на рис.45.





Рис.45. Реакции синтеза высших жирных кислот
После окончания цикла ацил-АПБ вступает в следующий цикл синтеза. К свободной SH-группе ацилпереносящего белка присоединяется новая молекула малонил-КоА. Затем происходит отщепление ацильного остатка, он переносится на малонильный остаток (с одновременным декарбоксилированием) и цикл реакций повторяется.
Таким образом, углеводородная цепочка будущей жирной кислоты постепенно растет (за каждый цикл – на два углеродных атома). Это происходит до момента, пока она не удлинится до 16 углеродных атомов (в случае синтеза пальмитиновой кислоты) или более (синтез других жирных кислот). Вслед за этим происходит тиолиз и образуется в готовом виде активная форма жирной кислоты – ацил-КоА.
Для нормального течения синтеза высших жирных кислот необходимы следующие условия:
1) Поступление углеводов, при окислении которых образуются необходимые субстраты и НАДФН 2 .
2) Высокий энергетический заряд клетки – высокое содержание АТФ, которое обеспечивает выход цитрата из митохондрий в цитоплазму.
Сравнительная характеристика b-окисления и синтеза высших жирных кислот:
1 . b-окисление протекает в митохондриях, а синтез жирных кислот протекает в цитоплазме на мембранах эндоплазматического ретикулума. Однако, образовавшийся в митохондриях ацетил-КоА через мембраны сам проходить не может. Поэтому существуют механизмы транспорта ацетил-КоА из митохондрий в цитоплазму с участием ферментов цикла Кребса (рис.46).

Рис.46. Механизм транспорта ацетил-КоА из митохондрий в цитоплазму.
Ключевыми ферментами ЦТК являются цитратсинтаза и изоцитратдегидрогеназа. Основные аллостерические регуляторы этих ферментов - это АТФ и АДФ. Если в клетке много АТФ, то АТФ выступает как ингибитор этих ключевых ферментов. Однако изоцитратдегидрогеназа угнетается АТФ сильнее, чем цитратсинтетаза. Это приводит к накоплению цитрата и изоцитрата в матриксе митохондрии. При накоплении цитрат выходит из митохондрии в цитоплазму. В цитоплазме есть фермент цитратлиаза. Этот фермент расщепляет цитрат на ЩУК и ацетил-КоА.
Таким образом, условием для выхода ацетил-КоА из митохондрии в цитоплазму является хорошее обеспечение клетки АТФ. Если АТФ в клетке мало, то ацетил-КоА расщепляется до СО 2 и Н 2 О.
2 . В ходе b-окисления промежуточные продукты связаны с HS-КоА, а при синтезе жирных кислот промежуточные продукты связаны с особым ацил-переносящим белком (АПБ). Это сложный белок. Его небелковая часть похожа по строению на КоА и состоит из тиоэтиламина, пантотеновой кислоты (витамин В 3) и фосфата.
3 . При b-окислении в качестве окислителя используются НАД и ФАД. При синтезе ЖК нужен восстановитель - используется НАДФ*Н 2 .
В клетке существует 2 основных источника НАДФ*Н 2 для синтеза жирных кислот:
а) пентозофосфатный путь распада углеводов;
Строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который образуется двумя путями: либо в результате окислительного декарбоксилирования пирувата. (см. рис. 11, Этап III), либо в результате b-окисления жирных кислот (см. рис. 8).
Рисунок 11 – Схема превращения углеводов в липиды
Напомним, что превращения образовавшегося при гликолизе пирувата в ацетил-КоА и его образование при b-окислении жирных кислот происходит в митохондриях. Синтез жирных кислот протекает в цитоплазме. Внутренняя мембрана митохондрий непроницаема для ацетил-КоА. Его поступление в цитоплазму осуществляется по типу облегченной диффузии в виде цитрата или ацетилкарнитина, которые в цитоплазме превращаются в ацетил-КоА, оксалоацетат или карнитин. Однако главный путь переноса ацетил-коА из митохондрии в цитозоль является цитратный (см. рис. 12).
Вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с HS-КоА и АТФ, вновь распадается на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитратлиазой. Уже в цитозоле оксалоацетат при участии цитозольной дикарбоксилат-транспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата, завершая тем самым так называемый челночный цикл:
Рисунок 12 – Схема переноса ацетил-КоА из митохондрий в цитозоль
Биосинтез насыщенных жирных кислот происходит в направлении, противоположном их b-окислению, наращивание углеводородных цепей жирных кислот осуществляется за счет последовательного присоединения к их концам двухуглеродного фрагмента (С 2) – ацетил-КоА (см. рис. 11, этап IV.).
Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуется СО 2 , АТФ, ионы Mn. Катализирует эту реакцию фермент ацетил-КоА – карбоксилаза. Фермент содержит в качестве простетической группы биотин (витамин Н). Реакция протекает в два этапа: 1 – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА:
Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Нужно отметить, что скорость биосинтеза жирных кислот определяется содержанием сахаров в клетке. Увеличение концентрации глюкозы в жировой ткани человека, животных и повышение скорости гликолиза стимулирует процесс синтеза жирных кислот. Это свидетельствует о том, что жировой и углеводный обмен тесно взаимосвязаны друг с другом. Важную роль здесь играет именно реакция карбоксилирования ацетил-КоА с его превращением в малонил-КоА, катализируемая ацетил-КоА-карбоксилазой. Активность последней зависит от двух факторов: наличия в цитоплазме высокомолекулярных жирных кислот и цитрата.
Накопление жирных кислот оказывает тормозящее влияние на их биосинтез, т.е. подавляют активность карбоксилазы.
Особая роль отводится цитрату, который является активатором ацетил-КоА-карбоксилазы. Цитрат в то же время играет роль связующего звена углеводного и жирового обменов. В цитоплазме цитрат вызывает двойной эффект в стимулировании синтеза жирных кислот: во-первых, как активатор ацетил-КоА-карбоксилазы и, во-вторых, как источник ацетильных групп.
Очень важной особенностью синтеза жирных кислот является то, что все промежуточные продукты синтеза ковалентно связаны с ацилпереносящим белком (HS-АПБ).
HS-АПБ – низкомолекулярный белок, который термостабилен, содержит активную HS-группу и в простетической группе которого содержится пантотеновая кислота (витамин В 3). Функция HS-АПБ аналогична функции фермента А (HS-КоА) при b-окислении жирных кислот.
В процессе построения цепи жирных кислот промежуточные продукты образуют эфирные связи с АБП (см. рис. 14):
Цикл удлинения цепи жирных кислот включает четыре реакции: 1) конденсации ацетил-АПБ (С 2) с малонил-АПБ (С 3); 2) восстановления; 3) дегидротации и 4) второго восстановления жирных кислот. На рис. 13 представлена схема синтеза жирных кислот. Один цикл удлинения цепи жирной кислоты включает четыре последовательных реакции.
Рисунок 13 – Схема синтеза жирных кислот
В первой реакции (1) – реакции конденсации – ацетильная и малонильные группы взаимодействуют между собой с образованием ацетоацетил-АБП с одновременным выделением СО 2 (С 1). Эту реакцию катализирует конденсирующий фермент b-кетоацил-АБП-синтетаза. Отщепленный от малонил-АПБ СО 2 – это тот же самый СО 2 , который принимал участие в реакции карбоксилирования ацетил-АПБ. Таким образом, в результате реакции конденсации происходит образование из двух-(С 2) и трехуглеродных (С 3) компонентов четырехуглеродного соединения (С 4).
Во второй реакции (2) – реакции восстановления, катализируемой b-кетоацил-АПБ-редуктазой, ацетоацетил-АПБ превращается в b-гидроксибутирил-АПБ. Восстанавливающим агентом служит НАДФН + Н + .
В третьей реакции (3) цикла-дегидратации – от b-гидроксибутирил-АПБ отщепляется молекула воды с образованием кротонил-АПБ. Реакция катлизируется b-гидроксиацил-АПБ-дегидратазой.
Четвертой (конечный) реакцией (4) цикла является восстановление кротонила-АПБ в бутирил-АПБ. Реакция идет под действием еноил-АПБ-редуктазы. Роль восстановителя здесь выполняет вторая молекула НАДФН + Н + .
Далее цикл реакций повторяется. Допустим, что идет синтез пальмитиновой кислоты (С 16). В этом случае образование бутирил-АПБ завершается лишь первый из 7 циклов, в каждом из которых началом является присоединение молекулы молонил-АПБ (С 3) – реакция (5) к карбоксильному концу растущей цепи жирной кислоты. При этом отщепляется карбоксильная группа в виде СО 2 (С 1). Этот процесс можно представить в следующем виде:
С 3 + С 2 ® С 4 + С 1 – 1цикл
С 4 + С 3 ® С 6 + С 1 – 2 цикл
С 6 + С 3 ® С 8 + С 1 –3 цикл
С 8 + С 3 ® С 10 + С 1 – 4 цикл
С 10 + С 3 ® С 12 + С 1 – 5 цикл
С 12 + С 3 ® С 14 + С 1 – 6 цикл
С 14 + С 3 ® С 16 + С 1 – 7 цикл
Могут синтезироваться не только высшие насыщенные жирные кислоты, но и ненасыщенные. Мононенасыщенные жирные кислоты образуются из насыщенных в результате окисления (десатурации), катализуруемой ацил-КоА-оксигеназой. В отличие от растительных тканей ткани животных обладают весьма ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные. Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из пальмитиновой и стеариновой кислот. В организме млекопитающих, в том числе и человека, не могут образовываться, например, из стеариновой кислоты (С 18:0) линолевая (С 18:2) и линоленовая (С 18:3) кислоты. Эти кислоты относятся к категории незаменимых жирных кислот. К незаменимым жирным кислотам относят также арахиновую кислоту (С 20:4).
Наряду с десатурацией жирных кислот (образование двойных связей) происходит и их удлинение (элонгации). Причем, оба эти процесса могут сочетаться и повторяться. Удлинение цепи жирной кислоты происходит путем последовательного присоединения к соответствующему ацил-КоА двууглеродных фрагментов при участии малонил-КоА и НАДФН+Н + .
На рисунке 14 представлены пути превращения пальмитиновой кислоты в реакциях десатурации и элонгации.
Рисунок 14 – Схема превращения насыщенных жирных кислот
в ненасыщенные
Завершается синтез любой жирной кислоты отщеплением HS-АПБ от ацил-АПБ под влиянием фермента деацилазы. Например:
Образовавшийся ацил-КоА является активной формой жирной кислоты.