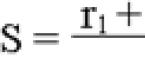Диффузионная недостаточность дыхания встречается при:
- утолщении альвеолярно-капиллярной мембраны (отечность);
- уменьшении площади альвеолярной мембраны;
- уменьшении времени контакта крови с альвеолярным воздухом;
- увеличении слоя жидкости на поверхности альвеол.
Типы расстройств ритма дыхательных движений
Наиболее часто встречающейся формой расстройств дыхательных движений является одышка. Различают инспираторную одышку, характеризующуюся затруднением вдоха, и экспираторную одышку с затруднением выдоха. Известна также смешанная форма одышки. Еще она бывает постоянной или приступообразной. В происхождении одышки зачастую играют роль не только заболевания органов Е дыхания, но и сердца, почек, системы кроветворения.
Вторая группа расстройств ритма дыхания - периодическое дыхание, т.е. групповой ритм, нередко чередующийся с остановками или со вставочными глубокими вдохами. Периодическое дыхание подразделяется на основные типы и варианты.
Основные типы периодического дыхания:
- Волнообразное.
- Неполный ритм Чейн-Стокса.
- Ритм Чейн-Стокса.
- Ритм Биота.
Варианты:
- Тонусные колебания.
- Глубокие вставочные вдохи.
- Альтернирующие.
- Сложные аллоритмии.
Выделяют следующие группы терминальных типов периодического дыхания.
- Большое дыхание Куссмауля.
- Апнейстическое дыхание.
- Гаспинг-дыхание.
Имеется и еще одна группа нарушений ритма дыхательных движений - диссоциированное дыхание.
Сюда включают:
- парадоксальные движения диафрагмы;
- асимметрию правой и левой половины грудной клетки;
- блок дыхательного центра по Пейнеру.
Одышка
Под одышкой понимается нарушение частоты и глубины дыхания, сопровождаемое чувством недостатка воздуха.
Одышка представляет собой реакцию системы внешнего дыхания, обеспечивающую повышенное снабжение организма кислородом и выведение избытка углекислоты (рассматривается как защитно-приспособительная). Наиболее эффективна одышка в форме увеличения глубины дыхания в сочетании с его учащением. Субъективные ощущения не всегда сопровождают одышку, поэтому ориентироваться следует на объективные показатели.
{module директ4}
Различают три степени недостаточности:
- I степень - возникает только при физическом напряжении;
- II степень - в покое обнаруживаются отклонения легочных объемов;
- III степень - характеризуется одышкой в покое и сочетается с избыточной вентиляцией, артериальной гипоксемией и накоплением недоокисленных продуктов обмена.
Дыхательная недостаточность и одышка как ее проявление -следствие при нарушения вентиляции и соответствующей недостаточной оксигенации крови в легких (при ограничении альвеолярной вентиляции, стенозе дыхательных путей, нарушениях кровообращения в легких).
Перфузионные расстройства имеют место при аномальных сосудистых и интракардиальных шунтах, заболеваниях сосудов.
Одышку вызывают и другие факторы - уменьшение церебрального кровотока, общая анемия, токсические и психические влияния.
Одно из условий формирования одышки - сохранение достаточно высокой рефлекторной возбудимости дыхательного центра. Отсутствие одышки при глубоком наркозе рассматривают как проявление торможения, создающегося в дыхательном центре в связи со снижением лабильности.
Ведущие звенья патогенеза одышки: артериальная гипоксемия, метаболический ацидоз, функциональные и органические поражения ЦНС, повышение обмена веществ, нарушение транспорта крови, затруднение и ограничение движений грудной клетки.
Нереспираторные функции легких
Основу нереспираторных функций легких составляют метаболические процессы, специфичные для органовдыхания. Метаболические функции легких заключаются в их участии в синтезе, депонировании, активации и разрушении различных биологически активных веществ (БАВ). Способность легочной ткани регулировать уровень ряда БАВ в крови получила название «эндогенный легочной фильтр» или «легочной барьер».
По сравнению с печенью легкие более активны в отношении метаболизма БАВ, так как:
- их объемный кровоток в 4 раза больше печеночного;
- только через легкие (за исключением сердца) проходит вся кровь, что облегчает метаболизм БАВ;
- при патологии с перераспределением кровотока («централизация кровообращения»), например, при шоке, легкие могут иметь решающее значение в обмене БАВ.
В ткани легких обнаружено до 40 типов клеток, из которых наибольшее внимание привлекают клетки, обладающие эндокринной активностью. Их называют клетками Фейтера и Кульчицкого, нейроэндокринными клетками или клетками АПУД-системы (апудоцитами). Метаболическая функция легких тесно связана с газотранспортной.
Так, при нарушениях легочной вентиляции (чаще гиповентиляции), нарушениях системной гемодинамики и кровообращения в легких отмечается повышенная метаболическая нагрузка.
Исследование метаболической функции легких при их разнообразной патологии позволило выделить три типа метаболических сдвигов:
- 1-й тип характеризуется повышением уровня БАВ в ткани, сопровождающимся увеличением активности ферментов их катаболизма (при острых стрессовых ситуациях - начальная стадия гипоксической гипоксии, ранняя фаза острого воспаления и др.);
- 2-му типу свойственно увеличение содержания БАВ, сочетающееся со снижением активности катаболических ферментов в ткани (при повторном воздействии гипоксической гипоксии, затянувшемся воспалительном бронхолегочном процессе);
- 3-й тип (обнаруживается реже) характеризуется дефицитом БАВ в легких, сочетающимся с подавлением активности катаболических ферментов (в патологически измененной ткани легкого при длительных сроках течения бронхоэктатической болезни).
Метаболическая функция легких оказывает существенное влияние на систему гемостаза, которая, как известно, принимает участие не только в поддержании жидкого состояния крови в сосудах и в процессе тромбообразования, но и влияет на гемореологические показатели (вязкость, агрегационную способность клеток крови, текучесть), гемодинамику и проницаемость сосудов.
Наиболее типичная форма патологии, протекающей с активацией свертывающей системы, - так называемый синдром «шокового легкого», характеризующийся диссеминированной внутрисосудистой коагуляцией крови. Синдром «шокового легкого» в основных чертах моделируется введением животным адреналина, обеспечивающего отек легочной ткани, образование геморрагических очагов, а также активацию калликреин-кининовой системы крови.
Обструктивные вентиляционные нарушения возникают вследствие: 1. сужения просвета мелких бронхов, особенно бронхиол за счет спазма (бронхиальная астма; астматический бронхит); 2. сужения просвета за счет утолщения стенок бронхов (воспалительный, аллергический, бактериальный отек, отек при гиперемии, сердечной недостаточности); 3. наличия на покрове бронхов вязкой слизи при увеличении ее секреции бокаловидными клетками бронхиального эпителия, или слизисто-гнойной мокроты 4. сужения вследствие рубцовой деформации бронха; 5. развития эндобронхиальной опухоли (злокачественной, доброкачественной); 6. сдавления бронхов извне; 7. наличия бронхиолитов.
Рестриктивные вентиляционные нарушения имеют следующий причины:
1. фиброз легких (интерстициальный фиброз, склеродермия, бериллиоз, пневмокониозы и т. д.);
2. большие плевральные и плевродиафрагмальные сращения;
3. экссудативный плеврит, гидроторакс;
4. пневмоторакс;
5. обширные воспаления альвеол;
6. большие опухоли паренхимы легкого;
7. хирургическое удаление части легкого.
Клинические и функциональные признаки обструкции:
1. Ранняя жалоба на одышку при ранее допустимой нагрузке или во время “прстуды”.
2. Кашель, чаще со скудным отделением мокроты, вызывающий после себя на некоторое время ощущение тяжелого дыхания (вместо облегчения дыхания после обычного кашля с отделением мокроты).
3. Перкуторный звук не изменен или вначале приобретает тимпанический оттенок над задне-боковыми отделами легких (повышение воздушности легких).
4. Аускультация: сухие свистящие хрипы. Последние, по Б. Е. Вотчалу, следует активно выявлять при форсированном выдохе. Аускультация хрипов при форсированном выдохе ценна в плане суждения о распространении нарушения бронхиальной проходимости по легочным полям. Дыхательные шумы изменяются в следующей полседовательности: везикулярное дыхание - жесткое везикулярное - жесткое неопределенное (заглушает хрипы)- ослабленное жесткое дыхание.
5. Более поздними признаками являются удлинение фазы выдоха, участие в дыхании вспомогательной мускулатуры; втяжение межреберных промежутков, опущение нижней границы легких, ограничение подвижности нижнего края легких, появление коробочного перкуторного звука и расширение зоны его распространения.
6. Снижение форсированных легочных проб (индекса Тиффно и максимальной вентиляции).
В терапии обструктивной недостаточности ведущее место занимают препараты бронходилатирующего ряда.
Клинические и функциональные признаки рестрикции.
1. Одышка при физической нагрузке.
2. Учащенное неглубокое дыхание (короткое - быстрый вдох и быстрый выдох, называемый феноменом “ захлапывающейся двери”).
3. Экскурсия грудной клетки ограничена.
4. Перкуторный звук укороченный с тимпаническим оттенком.
5. Нижняя граница легких стоит выше обычного.
6. Подвижность нижнего края легких ограничена.
7. Дыхание ослабленное везикулярное, хрипы трескучие или влажные.
8. Уменьшение жизненной емкости легких (ЖЕЛ), общей емкости легких (ОЕЛ), снижение дыхательного объема (ДО)и эффективной альвеолярной вентиляции.
9. Часто имеются нарушения равномерности распределения вентиляционно-перфузионных соотношений в легких и диффузные нарушения.
Раздельная спирография Раздельная спирография или бронхоспирография позволяет определить функцию каждого легкого, а следовательно, резервные и компенсаторные возможности каждого из них.
С помощью двухпросветной трубки, вводимой в трахею и бронхи, и снабженной раздувными манжетами для обтурации просвета между трубкой и слизистой бронха, имеется возможность получить воздух из каждого легкого и записать с помощью спирографа кривые дыхания правого и левого легкого раздельно.
Проведение раздельной спирографии показано для определения функциональных показателей у больных, подлежащих хирургическим вмешательствам на легких.
Несомненно, что более четкое представление о нарушении бронхиальной проходимости дает запись кривых скорости воздушного потока при форсированном выдохе (пик-флуориметрия).
Пневмотахометрия - является методом определения скорости движения и мощности струи воздуха при форсированном вдохе и выдохе с помощью пневмотахометра. Испытуемый после отдыха, сидя, делает максимально быстро глубокий выдох в трубку (при этом нос отключен при помощи носового зажима). Данный метод, главным образом, используется для подбора и оценки эффективности действия бронходилататоров.
Средние величины для мужчин - 4.0-7.0 л/л для женщин - 3.0-5.0 л/с При пробах с введением бронхоспазмолитических средств можно отдифференцировать ьронхоспазм от органических поражений бронхов. Мощность выдоха уменьшается не только при бронхоспазме, но также, хотя и в меньшей степени, у больных со слабостью дыхательной мускулатуры и с резкой ригидностью грудной клетки.
Общая плетизмография (ОПГ) - это метод прямого измерения величины бронхиального сопротивления R при спокойном дыхании. Метод основан на синхронном измерении скорости воздушного потока (пневмотахограммы)и колебаний давления в герметичной кабине, куда помещается больной. Давление в кабине изменяется синхронно колебаниям альвеолярного давления, о котором судят по коэффициенту пропорциональности между объемом кабины и объемом газа в легких. Плетизмографически лучше выявляются небольшие степени сужения бронхиального дерева.
Оксигемометрия - это бнскровное определение степени насыщения кислородом артериальной крови. Эти показания оксигемометра можно зарегистрировать на движущейся бумаге в виде кривой - оксигемограммы. В основе действия оксигемометра лежит принцип фотометрического определения спектральных особенностей гемоглобина. Большинство оксигемометров и оксигемографов не определяют абсолютной величины насыщения артериальной крови кислородом, а дают возможность только следить за изменениями насыщения крови кислородом. В практических целях оксигемометрия применяется для функциональной диагностики и оценки эффективности лечения. В целях диагностики оксигемометрия применяется для оценки состояния функции внешнего дыхания и кровообращения. Так, степень гипоксемии определяется с помощью различных функциональных проб. К ним относятся - переключение дыхания больного с воздуха на дыхание чистым кислородом и, наоборот, проба с задержкой дыхания на вдохе и на выдохе, проба с физической дозированной нагрузкой и др.
/ 13
ХудшийЛучший
Состояние организма, при котором система внешнего дыхания не обеспечивает нормального газового состава артериальной крови или его поддержание на нормальном уровне достигается за счет чрезмерного функционального напряжения этой системы. Таким образом, в понятии «дыхательная недостаточность» дыхание рассматривается лишь как внешнее дыхание, т. е. как процесс газообмена между атмосферой и кровью легочных капилляров, в результате которого происходит артериализация смешанной венозной крови. В то же время нормальная по газовому составу артериальная кровь еще не свидетельствует об отсутствии дыхательной недостаточности, так как за счет напряжения компенсаторных механизмов системы дыхания газы крбви долгое время остаются в пределах нормы и декомпенсация наступает лишь при II-III степени дыхательной недостаточности. Термин «легочная недостаточность» иногда употребляют как синоним «дыхательной недостаточности», однако легкое как орган не исчерпывает всех процессов, обеспечивающих внешнее дыхание, и в этом смысле употребление понятия «дыхательная недостаточность», или «недостаточность внешнего дыхания», является более правильным, так как оно охватывает и некоторые внелегочные механизмы недостаточности, например связанные с поражением дыхательной мускулатуры. Дыхательная недостаточность часто сочетается с сердечной недостаточностью. Такое сочетание отражают термины «легочно-сердечная» и «сердечно-легочная недостаточность». Иногда выделяют «рестриктивную» и «обструктивную» формы дыхательной недостаточности. Следует иметь в виду, что рестрикция и обструкция есть типы нарушения вентиляционной способности легких и характеризует лишь состояние аппарата вентиляции. Поэтому правильнее при анализе причин хронической дыхательной недостаточности выделять (по Н, Н. Канаеву) 5 групп факторов, приводящих к нарушению внешнего дыхания:
1 Поражение бронхов и респираторных структур легких:
а) поражение бронхиального дерева: повышение тонуса гладкой мускулатуры бронхов (бронхоспазм), отечно-воспалительные изменения бронхиального дерева, нарушение опорных структур мелких бронхов, снижение тонуса крупных бронхов (гипотоническая дискинезия);
б) поражение респираторных структур (инфильтрация легочной ткани, деструкция легочной ткани, дистрофия легочной ткани, пневмосклероз);
в) уменьшение функционирующей легочной паренхимы (недоразвитие легкого, сдавление и ателектаз легкого, отсутствие части легочной ткани после операции).
2. Поражение костномышечного каркаса грудной клетки и плевры (ограничение подвижности ребер, ограничение подвижности диафрагмы, плевральные сращения).
3. Поражение дыхательной мускулатуры (центральный и периферический паралич дыхательной мускулатуры, дегенеративнодистрофические изменения дыхательных мышц).
4. Нарушение кровообращения в малом круге (редукция сосудистого русла легких, спазм легочных артериол, застой крови в малом круге).
5. Нарушение регуляции дыхания (угнетение дыхательного центра, дыхательные неврозы, нарушение местных регуляторных отношений).
Основным клиническим критерием дыхательной недостаточности является одышка. В зависимости от ее выраженности при различном физическом напряжении принято различать 3 степени дыхательной недостаточности. При I степени одышка возникает при физических нагрузках, превышающих повседневные, цианоз обычно не выявляется, утомляемость наступает быстро, но вспомогательная дыхательная мускулатура в дыхании не участвует. При II степени одышка возникает при выполнении большинства привычных повседневных нагрузок, цианоз выражен нерезко, утомляемость выраженная, при нагрузке включается вспомогательная мускулатура дыхания. При III степени одышка отмечается уже в покое, цианоз и утомляемость резко выражены, постоянно в дыхании участвует вспомогательная мускулатура.
Функционально-диагностическое исследование, даже если оно включает лишь общую спирографию и исследование газов крови, может оказать клиницисту существенную помощь в уточнении степени дыхательной недостаточности. При отсутствии нарушений вентиляционной способности легких наличие у больного дыхательной недостаточности маловероятно. Умеренные (а иногда и значительные) обструктивные нарушения чаще всего бывают связаны с дыхательной недостаточностью I степени. Значительная обструкция позволяет предполагать I или II степень, а резкая обструкция - II или III степень дыхательной недостаточности. Рестриктивные нарушения сравнительно мало сказываются на газотранспортной функции системы внешнего дыхания. Значительная и даже резкая рестрикция чаще всего сопровождается лишь дыхательной недостаточностью II степени. Гипоксемия в покое чаще всего свидетельствует о недостаточности дыхания или кровообращения. Умеренная гипоксемия может говорить о I степени дыхательной недостаточности, резкая гипоксемия - свидетельство более тяжелых ее степеней. Стойкая гиперкапния почти всегда сопровождает II-III степень дыхательной недостаточности.
Острая дыхательная недостаточность (ОДН) характеризуется быстрым развитием состояния, при котором легочный газообмен становится недостаточным для обеспечения организма необходимым количеством кислорода. Наиболее частые причины ОДН: закупорка дыхательных путей инородным телом, аспирация рвотных масс, крови или других жидкостей; бронхо - или ларингоспазм; отек, ателектаз или коллапс легкого; тромбоэмболия в системе легочной артерии; дисфункция дыхательной мускулатуры (полиомиелит, столбняк, травмы спинного мозга, последствия воздействия фосфорорганических веществ или миорелаксантов); угнетение дыхательного центра при отравлениях наркотиками, снотворными или при черепно-мозговой травме; массивные острые воспалительные процессы в легочной паренхиме; синдром шокового легкого; резкий болевой синдром, препятствующий нормальному осуществлению дыхательных экскурсий.
В оценке тяжести ОДН, связанной с нарушением вентиляции, важное значение имеет исследование парциального давления СО 2 и О 2 в артериальной крови.
Терапия ОДН требует интенсивных реанимационных мероприятий, направленных иа устранение причин, вызвавших гиповентиля-цию, стимуляцию активного самостоятельного дыхания, анестезию в случаях тяжелых травматических повреждений, искусственную вентиляцию легких (в том числе вспомогательную), оксигенотерапию и коррекцию КОС.
Дыхательная недостаточность
Дыхательная недостаточность (ДН) – неспособность дыхательной системы поддерживать нормальный газовый состав крови в покое либо при нагрузке. ДН характеризуется снижением напряжения кислорода меньше 80 мм.рт.ст. и повышением напряжения углекислого газа больше 45 мм.рт.ст. ДН проявляется респираторной гипоксией, а также респираторным ацидозом. Выделяют комплекс ДН, при котором изменение газового состава крови возникает только при напряжении и декомпенсации, когда изменение газового состава наблюдается в покое, бывает: острое и хроническое.
По патогенезу делят на:
Нарушение альвеолярной вентиляции
Нарушение диффузии газов в легких
Нарушение перфузии крови по сосудам легких
Нарушение перфузионно-вентиляционных соотношений
1.Нарушение альвеолярной вентиляции
Нарушение нервной регуляции .
Возникают:
При повреждении или угнетении дыхательного центра из-за травмы, кровоизлияния, опухоли, абсцессов, под действием биодепрессантов.
При нарушении функции спинальных мотонейронов из-за травм спинного мозга, опухоли, полиомиелита.
При повреждении межреберных и диафрагмальных нервов из-за травм невритов, авитаминозов и т.д.
При нарушении нервно-мышечной передачи, при ботулизме, миастении, действии миорелаксантов.
При повреждении дыхательной мускулатуры – межреберных мышц и диафрагмы.
При данной форме дыхательной недостаточности нарушается работа дыхательной мускулатуры, из-за чего снижаются МОД, ДО, быстро развивается гипоксия и компенсация невозможна, поэтому данная форма ДН приводит к развитию асфиксии.
Обструктивные нарушения
При закупорке дыхательных путей. Может возникнуть на уровне магистральных дыхательных путей и на уровне мелких бронхов.
Обструкция магистральных дыхательных путей возникает при: ларингоспазме, отеке гортани, инородных телах гортани, трахеи и бронхов.
Обструкция мелких бронхов возникает при бронхоспазме, при отеке, при гиперсекреции слизи.
При обструкции в большей степени затрудняется фаза выдоха. Это приводит к развитию экспираторной одышки. При этом глубина дыхания увеличивается, а частота – снижается. При сильной обструкции в легких увеличивается остаточный объем, что может привести к развитию острой эмфиземы.
Компенсация обструктивных нарушений осуществляется за счет усиления работы дыхательной мускулатуры. Однако недостатком данной компенсации является то, что интенсивно работающая дыхательная мускулатура потребляет большое количество кислорода, что усугубляет гипоксию.
Рестрективные нарушения
Рестрикция – это нарушение расширения легких в фазу вдоха. Рестрективные нарушения могут возникать в результате внутрилегочных и внелегочных причин. К первым относятся:
Фиброз легких (развивается в результате туберкулеза, саркоидоза, хронических пневмоний, аутоиммунных заболеваний).
Дистресс-синдром новорожденных (возникает из-за нарушения синтеза сурфактанта – наблюдается чаще всего у недоношенных) и взрослых (развивается при разрушении сурфактанта, что может случиться при шоке, при вдыхании токсических веществ и при воспалительных процессах в легких).
Внелегочные причины: пневмоторакс или скопление воздуха в грудной клетке и плевральной полости – при травмах, гидроторакс – скопление жидкости в плевральной полости – в виде экссудата при экссудативных плевритах.
При рестрективных нарушениях страдает фаза вдоха, развивается инспираторная одышка, До снижается, частота дыхания увеличивается, дыхание становится частым, но поверхностным. Учащение дыхания является компенсаторным механизмом поддержания объема дыхания. Недостатком этой компенсации является то, что в альвеолы попадает мало воздуха, а большая его часть вентилирует анатомически мертвое пространство дыхательных путей.
2.Нарушение диффузии газов в легких
M = KS / LΔ П
M – диффузия, K – коэффициент диффузии газов (зависит от проницаемости альвеолярно-капиллярной мембраны), S – суммарная площадь диффузионной поверхности, L – длина диффузионного пути, Δ П – градиент концентрации кислорода и углекислого газа между альвеолярным воздухом и кровью.
Таким образом причинами нарушения диффузии является увеличение диффузионного пути газа, уменьшение суммарной площади диффузионной поверхности и снижение проницаемости альвеолярно-капиллярной мембраны.
Диффузионных путь состоит из стенки альвеолы, капилляра и интерстициального пространства между ними. Увеличение диффузионного пути возникает при фиброзах легких (туберкулез, саркоидоз), а также при скоплении жидкости в интерстициальном пространстве, что наблюдается при отеке легких. Эти же причины влияют и на снижение проницаемости альвеолярно-капиллярной мембраны и на уменьшение суммарной площади диффузной поверхности легких. Возникают при всех вида рестрективных нарушений.
3.Нарушение перфузии крови по сосудам легких
Возникает при нарушении кровообращения в малом круге. Причины:
Недостаточное поступление крови в малый круг кровообращения из-за стеноза клапанов или устья легочного ствола (из-за тромбоэмболии легочных артерий)
Увеличение давления в малом круге кровообращения, из-за чего развивается легочная гипертензия и склерозируются сосуды легких. Это возникает при открытом артериальном протоке (Баталов проток), при дефектах межпредсердной и межжелудочковой перегородок
При застое крови в малом круге кровообращения, что возникает при левожелудочковой сердечной недостаточности и приводит к отеку легких.
4.Нарушение перфузионно-вентиляционных соотношений
Развивается при увеличении в легких функционально мертвого пространства (совокупность альвеол, которые хорошо перфузируются, но плохо вентилируются). Это происходит при диффузных поражениях легочной ткани и множественных ателектазах. При этом увеличивается количество перфузируемых альвеол (при хронической эмфиземе, обструктивных и рестрективных заболеваниях).
Одышка
Это субъективные ощущения нехватки воздуха, сопровождающиеся объективным нарушением частоты и глубины дыхания.
1. Инспираторная одышка . Проявляется затруднением фазы вдоха. Наблюдается при рестрективных нарушениях альвеолярной вентиляции.
2. Экспираторная одышка . Проявляется затруднением фазы выдоха. Наблюдается при обструктивных нарушениях фазы вентиляции.
3. Смешанная одышка . Нарушаются фазы вдоха и выдоха.
Основную роль в формировании одышки выполняют проприорецепторы дыхательной мускулатуры, раздражение которых возникает при усилении работы дыхательной мускулатуры. При этом сигнал поступает в дыхательный центр, так же активизируется стресс-реакция, и информация поступает в лимбическую систему, где и формируется ощущение нехватки воздуха либо невозможности осуществлять полноценное дыхание. Кроме того, в формировании одышки играют роль и другие рецепторы: хеморецепторы синокаротидной зоны и дуги аорты, которые реагируют на гипоксию и гипокапнию; рецепторы растяжения бронхов и рецепторы спадения альвеол реагируют на обструктивные и рестрективные нарушения; а также интерстициальные J-рецепторы, которые активизируются при повышении давления в интерстициальном пространстве, что бывает при отеке.
Патологические типы дыхания
Гиперпноэ – глубокое дыхании, которое развивается при обструкции, при повышении тонуса сипматической системы, при ацидозе. Разновидностью гиперпноэ является большое ацидотическое дыхание Куссмауля, которое наблюдается при диабетическом кетоацидозе.
Тахипноэ – это увеличение частоты дыхания. Возникает при рестрективных нарушениях при нарушении тонуса симпатической системы.
Брадипноэ – редкое дыхание. Возникает при обструкции, при угнетении дыхательного центра, при повышении системного артериального давления, при алкалозе.
Апноэ – отсутствие дыхания. Может быть кратковременным при периодических формах дыхания, может быть полная остановка дыхания.
Апнейстическое дыхание – характеризуется длинным судорожным вдохом, прерывается коротким выдохом, возникает при раздражении инспираторного отдела дыхательного центра из-за кровоизлияния.
Агональное дыхание – единичные вдохи, чередующиеся с периодами апноэ разной длительности, возникает при нарушении поступления афферентных импульсов в дыхательный центр и характеризуются остаточно угасающей активностью самого дыхательного центра.
Периодическое дыхание Чейн-Стокса . Характеризуется нарастающими по силе дыхательными движениями, которые чередуются с периодами апноэ. Возникает при гиперкапнии либо при нарушении чувствительности дыхательного центра к углекислому газу.
Дыхание Биота – характеризуется периодами апноэ, после которых следуют одинаковые по амплитуде дыхательные движения, наблюдается при различных поражениях ЦНС.
Асфиксия – удушье, форма дыхательной недостаточности, возникает при тотальной обструкции дыхательных путей, либо при выраженном нарушении нервной регуляции и – дыхательной мускулатуры.
В течение асфиксии выделяют две стадии:
Компенсация (происходит выраженная симпато-адреналовой системы, что сопровождается возбуждением, паникой и страхом, попытками освободить дыхательные пути и совершить дыхательные движения). Характерны: централизация кровообращения, тахикардия и увеличение АД.
Декомпенсация (из-за снижения парциального давления кислорода в крови происходит угнетение ЦНС, что приводит к потере сознания, судорогам, остановке дыхания, падению систолического артериального давления, брадикардии, что приводит к смерти).
Рестриктивный тип (от лат. restrictio - ограничение) гиповентиляции наблюдается при ограничении расправления легких. Причинные механизмы таких ограничений могут лежать внутри легких или вне их.
Внутрилегочные формы обусловлены возрастанием эластического сопротивления легких. Это происходит при обширных пневмониях, пневмофиброзе, ателектазах и других патологических состояниях. Большое значение для развития рестриктивного типа ограничения расправлению легких имеет дефицит сурфактанта. К этому приводят многие факторы, начиная от нарушения легочной гемодинамики, вируса гриппа до повреждающего воздействия табачного дыма, повышенной концентрации кислорода, вдыхания различных газов.
Рестриктивные расстройства дыхания внелегочного происхождения возникают при ограничении экскурсии грудной клетки. Это может быть следствием легочной патологии (плевриты) или грудной клетки (переломы ребер, чрезмерное окостенение реберных хрящей, невриты, сдавление грудной клетки). Поражение костно-мышечного каркаса грудной клетки и плевры препятствует расправлению легких и уменьшает их воздухонаполненность. При этом число альвеол сохраняется таким же, как в норме.
С одной стороны, рост сопротивления растяжению во время вдоха требует большей работы дыхательных мышц. С другой - для поддержания должного объема МОД при уменьшение величины вдоха необходимо увеличить частоту дыхательных движений, что происходит за счет укорочения выдоха, то есть дыхание становится более частым и поверхностным. В развитии поверхностного дыхания принимают участие и различные рефлексы. Так, при раздражении ирритантных и юкстамедуллярных рецепторов может быть тахипное, но уже за счет укорочения вдоха. Такой же эффект может быть и при раздражении плевры.
Гипервентиляция
Выше рассматривались нарушения дыхания гиповентиляционного типа. Они чаще всего приводят лишь к уменьшению поступления кислорода в кровь. Значительно реже при этом происходит недостаточное выведение углекислого газа. Это обусловлено тем, что СО 2 более чем в двадцать раз легче проходит через аэрогематический барьер.
Другое дело гипервентиляция. При начале ее происходит лишь некоторое увеличение кислородной емкости крови за счет небольшого роста парциального давления кислорода в альвеолах. Но зато возрастает выведение углекислого газа и может развиваться респираторный алкалоз . Для его компенсации может изменяться электролитный состав крови со снижением в крови уровня кальция, натрия и калия.
Гипокапния может привести к снижению утилизации кислорода, так как при этом кривая диссоциации оксигемоглобина сдвигается влево. Это скажется в первую очередь на функции тех органов, которые забирают большее количество кислорода из протекающей крови: на сердце и головном мозге. Кроме того не следует забывать, что гипервентиляция осуществляется за счет интенсификации работы дыхательных мышц, которые при резком ее усилении могут потреблять до 35% и больше всего кислорода.
Результатом гипервентиляционной гипокапнии может быть повышение возбудимости коры головного мозга. В условиях продолжительной гипервентиляции возможны эмоциональные и поведенческие расстройства, а при значительной гипокапнии может наступить потеря сознания. Одним из характерных признаков выраженной гипокапнии, при снижении РаСО 2 до 20-25 мм рт.ст., является появление судорог и спазма скелетных мышц. Это обусловлено во многом нарушением обмена кальция и магния между кровью и скелетными мышцами.
Обструктивный бронхит . В генезе обструкции бронхов ведущая роль принадлежит отеку слизистой в результате воспаления и чрезмерной секреции слизи. При бронхитах происходит изолированное нарушение проходимости дыхательных путей. Неоднородность механических свойств легких выступает в качестве одного из наиболее характерных проявлений обструктивной патологии. Зоны с различным бронхиальным сопротивлением и величиной растяжимости имеют разные временные характеристики, поэтому при одном и том же плевральном давлении процесс их опорожнения и заполнения воздухом происходит с различной скоростью. В результате неизбежно нарушается распределение газов и характер вентиляции в различных отделах легких.
Вентиляция зон с низкими временными характеристиками при учащении дыхания значительно ухудшается и вентилируемый объем уменьшается. Это проявляется снижением растяжимости легких. Прилагаемые больным усилия, ускоряя и учащая дыхание, приводят к еще большему увеличению вентиляции хорошо вентилируемых зон и к дальнейшему ухудшению вентиляции плохо вентилируемых отделов легких. Возникает своего рода порочный круг.
При дыхании невентилируемые зоны подвергаются компрессии и декомпрессии, на что уходит значительная доля энергии дыхательной мускулатуры. Возрастает так называемая неэффективная работа дыхания. Сдавление на выдохе и растяжение на вдохе "воздушного пузыря" приводят к изменению объема грудной клетки, который не обеспечивает возвратно-поступательного движения воздуха в легкие и из них. Постоянная хроническая перегрузка дыхательной мускулатуры приводит к снижению их сократительной способности и нарушению нормального режима функционирования. Об ослаблении дыхательной мускулатуры у таких больных свидетельствует также снижение способности развивать большие дыхательные усилия.
Из-за одновременно происходящего сокращения кровеносных сосудов снижается общий кровоток через спавшуюся часть легкое. Компенсаторной реакцией этого является направление крови в вентилируемые отделы легких, где происходит хорошее насыщение крови кислородом. Зачастую через такие отделы легких проходит до 5/6 всей крови. В результате суммарный коэффициент вентиляционно-перфузионного соотношения падает весьма умеренно, и даже при полном выпадении вентиляции целого легкого в аортальной крови наблюдается лишь незначительное уменьшение насыщения кислородом.
Обструктивный бронхит, проявляя себя сужением бронхов (а это приводит к увеличению бронхиального сопротивления), обусловливает снижение объемной скорости выдоха за 1 секунду. При этом ведущее значение в патологическом затруднении дыхания принадлежит обструкции малых бронхиол. Эти участки бронхов легко закрываются при: а) сокращении гладких мышц в их стенке, б) накоплении воды в стенке, в) появлении слизи в просвете. Существует мнение, что хроническая форма обструктивного бронхита формируется только тогда, когда возникает стойкая обструкция, длящаяся не менее 1 года и не ликвидирующаяся под влиянием бронхолитических средств.
Нервно-рефлекторные и гуморальные механизмы регуляции мышц бронхов. В связи с относительно слабой иннервацией бронхиол со стороны симпатической нервной системы рефлекторное влияние их (при выполнении мышечной работы, при стрессах) не велико. В большей мере может проявляться влияние парасимпатического отдела (n. vagus). Их медиатор ацетилхолин приводит к некоторому (относительно умеренному) спазму бронхиол. Иногда парасимпатическое влияние реализуется при раздражении некоторых рецепторов самих легких (см. далее), при окклюзии малых легочных артерий микроэмболами. Но парасимпатическое влияние может быть более выраженным при возникновении бронхоспазма при некоторых патологических процессах, например, при бронхиальной астме.
Если влияние медиатора симпатических нервов НА не столь значимо, то гормональный путь, обусловленный воздействием через кровь А и НА надпочечников, через β-адренорецепторы вызывает расширение бронхиального дерева. Биологически активные соединения, образующиеся в самих легких, такие как гистамин, медленнодействующая анафилактическая субстанция, высвобождающиеся из тучных клеток при аллергических реакциях, являются мощными факторами приводящими к спазму бронхов.
Бронхиальная астма . При бронхиальной астме в обструкции бронхов ведущую роль играет активное сужение вследствие спазма гладкой мускулатуры . Поскольку гладкомышечная ткань представлена главным образом в крупных бронхах, то бронхоспазм выражается преимущественно их сужением. Однако это не единственный механизм бронхиальной обструкции. Большое значение имеет аллергический отек слизистой бронхов, который сопровождается нарушением проходимости бронхов более мелкого калибра. Нередко наблюдается скопление в бронхах вязкого, трудно отделяемого стекловидного секрета (дискриния), при этом обструкция может приобретать чисто обтурационный характер. Кроме того нередко присоединяется и воспалительная инфильтрация слизистой с утолщением базальной мембраны эпителия.
Бронхиальное сопротивление повышается как при вдохе, так и при выдохе. При развитии астматического приступа нарушения дыхания могут нарастать с угрожающей стремительностью.
У больных бронхиальной астмой чаще, чем при другой патологии легких, наблюдается альвеолярная гипервентиляция как проявление нарушений центральной регуляции дыхания. Она имеет место, как в фазу ремиссии, так и при наличии даже выраженной бронхообструкции. Во время приступа удушья нередко бывает фаза гипервентиляции, которая при нарастании астматического состояния сменяется фазой гиповентиляции.
Уловить этот переход чрезвычайно важно, поскольку выраженность дыхательного ацидоза является одним из важнейших критериев тяжести состояния больного, что и определяет врачебную тактику. При повышении РаСO 2 выше 50-60 мм рт.ст. возникает необходимость проведения экстренной интенсивной терапии.
Артериальная гипоксемия при бронхиальной астме, как правило не достигает тяжелой степени. В фазу ремиссии и при легком течение может возникать умеренно выраженная артериальная гипоксемия. Лишь во время приступа РаО 2 может снижаться до 60 мм рт.ст. и ниже, что также оказывается важным критерием в оценке состояния больного. Основным механизмом развития гипоксемии является нарушение вентиляционно-перфузионных отношений в легких. Поэтому артериальная гипоксемия может наблюдаться и при отсутствии гиповентиляции.
Слабые движения диафрагмы, перерастяжение легких и большие колебания внутриплеврального давления приводят к тому, что во время приступа существенно страдает и кровообращение. Кроме тахикардии и выраженного цианоза на вдохе может резко снижаться систолическое давление.
Как было указано ранее при астме диаметр бронхиол при выдохе становится меньше, чем при вдохе, что происходит от спадения бронхиол вследствие усиления выдоха, сдавливающего дополнительно бронхиолы снаружи. Поэтому больной может вдыхать без затруднения, а выдыхать с большим трудом. При клиническом обследовании можно обнаружить наряду с уменьшением объема выдоха и снижение скорости максимального выдоха.
Хронические неспецифические заболевания легких (ХНЗЛ). Главной особенностью ХНЗЛ является преимущественно бронхогенный генез их развития. Именно это и определяет тот факт, что при всех формах данной патологии ведущим синдромом являются нарушения бронхиальной проходимости. Обструктивными болезнями легких страдают 11-13% людей. В так называемых развитых странах смертность от данного типа патологий за каждые 5 лет удваивается. Основная причина данной ситуации заключается в курении и загрязнении окружающей среды (см. раздел "Экология").
Характер ХНЗЛ, выраженность их, также как и другие механизмы нарушений внешнего дыхания, имеют свои особенности.
Если в норме отношение альвеолярной вентиляции к минутному объему дыхания составляет 0,6-0,7, то при тяжелом хроническом бронхите оно может снижаться до 0,3. Поэтому для поддержания должного объема альвеолярной вентиляции необходимо значительное увеличение минутного объема дыхания. Кроме того наличие артериальной гипоксемии и обусловленного этим метаболического ацидоза требует компенсаторного усиления вентиляции легких.
Увеличение растяжимости легких объясняет сравнительно редкое и глубокое дыхание, склонность к гипервентиляции у больных эмфизематозного типа хронического бронхита. Напротив, при бронхитическом типе снижение растяжимости легких обусловливает менее глубокое и более частое дыхание, что с учетом увеличения мертвого дыхательного пространства создает предпосылки для развития гиповентиляционного синдрома. Не случайно, что из всех показателей механики дыхания наиболее тесная корреляция РаСО 2 установлена именно с растяжимостью легких, тогда как с бронхиальным сопротивлением такая связь практически отсутствует. В патогенезе гиперкапнии при этом значительное место, наряду с нарушениями механики дыхания, принадлежит снижению чувствительности дыхательного центра.
Своеобразные различия отмечаются и со стороны кровообращения в малом круге. Бронхитическому типу свойственно раннее развитие легочной гипертензии и "легочного сердца". Несмотря на это, минутный объем кровообращения, как в состоянии покоя, так и при нагрузке значительно больше, чем при эмфизематозном типе. Это объясняется тем, что при эмфизематозном типе из-за малой объемной скорости кровотока, даже при меньшей выраженности артериальной гипоксемии тканевое дыхание страдает больше, чем при бронхитическом, при котором, даже при наличии артериальной гипоксемии, но достаточном объемном кровотоке, значительно лучше происходит обеспечение тканей организма O 2 . Следовательно, эмфизематозный тип можно определить как гипоксический, а бронхитический - как гипоксемический.
При наличии бронхиальной обструкции закономерно отмечается увеличение ООЛ и его отношения к ЖЕЛ. ЖЕЛ чаще всего остается в пределах нормы, хотя могут отмечаться ее отклонения, как в сторону снижения, так и увеличения. Как правило, возрастает неравномерность вентиляции. Диффузионные нарушения обычно наблюдаются примерно в половине случаев. Несомненна в ряде случаев роль снижения диффузионной способности легких в патогенезе артериальной гипоксемии при данном заболевании, однако ведущее значение в ее развитии принадлежит нарушениям вентиляционно-перфузионных отношений в легких и анатомическому шунтированию венозной крови в артериальное русло, минуя легочные капилляры.
На ранних стадиях заболевания выраженность артериальной гипоксемии невелика. Наиболее характерным сдвигом кислотно-основного состояния крови является метаболический ацидоз, обусловленный прежде всего интоксикацией организма. Гиповентиляция, дыхательные нарушения кислотно-основного состояния крови и выраженная артериальная гипоксемия свойственны далеко зашедшей стадии патологического процесса, в клинической картине которой доминируют уже не бронхоэктазы, а тяжелый бронхит.
Хронический бронхит. Наиболее распространенной формой бронхолегочной патологии среди ХНЗЛ является хронический бронхит. Это периодически обостряющийся хронический воспалительный процесс, протекающий с преимущественным поражением дыхательных путей диффузного характера. Одним из частых проявлений этого заболевания является генерализованная бронхиальная обструкция.
Углубленное функциональное исследование позволяет у больных необструктивным бронхитом выявить начальные нарушения дыхания. Методы, используемые для этих целей, можно разделить на 2 группы. Одни позволяют оценить показатели механической негомогенности легких: снижение объемных скоростей воздушного потока, при форсированном выдохе второй половины ЖЕЛ, снижение растяжимости легких по мере учащения дыхания, изменение показателей равномерности вентиляции и др. Другая группа позволяет оценить нарушения легочного газообмена: снижение РаO 2 , рост альвеолярно-артериального градиента РO 2 , капнографические нарушения вентиляционно-перфузионных отношений и др. Именно это и обнаруживается у больных с умеренно выраженной патологией легких (необструктивный бронхит, бронхит курильщика) и сочетаются с увеличением ОО легких и емкости экспираторного закрытия воздухоносных путей.
Ателектазы . Основные причины появления их две: обструкция бронхов и нарушение синтеза сурфактантов . При обструкции бронхов в неаэрируемых альвеолах в связи с поступлением из них в кровоток газов развивается их коллапс. Снижение давления способствует поступлению в альвеолы жидкости. Результатом таких изменений является механическое сдавление кровеносных сосудов и снижение кровотока через данные отделы легких. К тому же развивающаяся здесь гипоксия со своей стороны приводит к развитию вазоконстрикции. Результатом возникающегося перераспределения крови между интактным легким и пораженным ателектатическими процессами будет улучшение газотранспортной функции крови.
Усиливается ателектаз и вследствие снижения образования сурфактантов, которые в норме препятствуют действию сил поверхностного натяжения легких.
Назначение сурфактанта, покрывающего – внутреннюю поверхность альвеол и снижающего в 2-10 раз поверхностное напряжение, обеспечивает сохнанение альвеол от спадения. Однако при некоторых патологических состояниях (не говоря уже о новорожденных недоношенных детях) количество сурфактанта снижается настолько, что поверхностное натяжение альвеолярной жидкости оказывается в несколько раз выше нормы, что приводит к исчезновению альвеол – и в первую очередь самых маленьких. Это происходит не только при, так называемой, болезни гиалиновых хрящей , но и при длительном нахождении рабочих в запыленной атмосфере. Последнее приводит к появлению ателектазов легких.
4.1.16. Нарушения дыхания при туберкулезе легких .
Эта патология чаще всего развивается в верхних долях легких, там где обычно снижена и аэрация, и кровообращение. Нарушения дыхания выявляются у большинства больных активным туберкулезом легких, у значительного числа больных в неактивной фазе и у многих лиц, излеченных от него.
Непосредственными причинами развития нарушений дыхания у больных активным туберкулезом легких являются специфические и неспецифические изменения легочной ткани, бронхов и плевры, а также туберкулезная интоксикация. При неактивных формах туберкулеза и у излеченных лиц в качестве причины нарушений дыхания выступают специфические и, главным образом, неспецифические изменения легочной ткани, бронхов и плевры. Неблагоприятное влияние на дыхание могут оказывать и нарушения гемодинамики в малом и большом кругах кровообращения, а также регуляторные расстройства токсического и рефлекторного происхождения.
Среди проявлений дыхательных нарушений у больных наиболее часто отмечается снижение вентиляционной способности легких, частота и выраженность которой нарастают по мере увеличения распространенности туберкулезного процесса и степени интоксикации. Примерно в одинаковой степени встречаются 3 типа нарушений вентиляции: ограничительный, обструктивный и смешанный.
В основе рестриктивных нарушений лежит уменьшение растяжимости легочной ткани, обусловленное фиброзными изменениями легких и снижением поверхностно-активных свойств легочных сурфактантов. Большое значение имеют также свойственные туберкулезному процессу изменения легочной плевры.
В основе обструктивных вентиляционных нарушений лежат анатомические изменения бронхов и перибронхиальной легочной ткани, а также функциональный компонент бронхообструкции - бронхоспазм. Возрастание бронхиального сопротивления возникает уже в первые месяцы заболевания туберкулезом и прогрессирует по мере увеличения его продолжительности. Наиболее высокое бронхиальное сопротивление определяется у больных фиброзно-кавернозным туберкулезом и у пациентов с обширными инфильтратами и диссеминацией в легких.
Бронхоспазм выявляется примерно у половины больных активным туберкулезом легких. Частота его обнаружения и выраженность нарастают при прогрессировании туберкулезного процесса, увеличении длительности заболевания и возраста больных. Наименьшая выраженность бронхоспазма отмечается у больных свежим ограниченным туберкулезом легких без распада. Большая выраженность характерна для пациентов со свежими деструктивными процессами, а наиболее тяжелые нарушения бронхиальной проходимости встречаются при фиброзно-кавернозном туберкулезе легких.
В целом при туберкулезе легких ограничительные нарушения вентиляции имеют большее значение, чем при неспецифических заболеваниях. Частота и выраженность обструктивных нарушений, напротив, несколько меньше. Тем не менее, доминирующим является нарушения бронхиальной проходимости. Они обусловлены, главным образом, метатуберкулезными неспецифическими изменениями бронхов, которые закономерно возникают при длительно существующем специфическом процессе. Кроме того, у ряда больных туберкулез легких развивается на фоне длительно текущего неспецифического воспалительного процесса, чаще всего, хронического бронхита, который и определяет характер и выраженность имеющихся нарушений дыхания.
Рост эластического и неэластического (преимущественно бронхиального) сопротивления дыханию приводит к увеличению энергетической стоимости вентиляции. Увеличения работы дыхания не отмечено только у больных с очаговым туберкулезом легких. При инфильтративном и ограниченном диссеминированном процессе работа дыхания, как правило, увеличена, а при распространенном диссеминированном и фиброзно-кавернозном процессах еще более возрастает.
Другим проявлением возникающих при туберкулезе поражений легочной паренхимы, бронхов и плевры является неравномерность вентиляции. Она обнаруживается у больных, как в активной, так и в неактивной фазе заболевания. Неравномерность вентиляции способствует возникновению несоответствия между вентиляцией и кровотоком в легких. Избыточная относительно кровотока вентиляция альвеол приводит к увеличению функционального мертвого дыхательного пространства, снижению доли альвеолярной вентиляции в общем объеме вентиляции легких, увеличению альвеолярно-артериального градиента РO 2 , что наблюдается у больных с ограниченным и распространенным туберкулезом легких. Зоны с низким отношением вентиляция/кровоток ответственны за развитие артериальной гипоксемии, что является ведущим механизмом снижения РаO 2 у больных.
У преобладающего числа больных гематогенно-диссеминированным и фиброзно-кавернозным туберкулезом легких обнаруживается снижение диффузионной способности легких. Ее снижение прогрессирует с увеличением распространенности рентгенологически выявляемых изменений в легких и выраженности вентиляционных нарушений по ограничительному типу. Снижение диффузионной способности легких происходит в связи с уменьшением объема функционирующей легочной ткани, соответствующим уменьшением поверхности газообмена и нарушением проницаемости для газов аэрогематического барьера.
Артериальная гипоксемия у таких больных выявляется преимущественно при физической нагрузке и значительно реже - в условиях покоя. Выраженность ее колеблется в широких пределах, у больных фиброзно-кавернозным туберкулезом легких насыщение артериальной крови O 2 может снижаться до 70 % и менее. Наиболее выраженная гипоксемия наблюдается при хронических процессах большой протяженности, сочетающихся с обструктивным бронхитом и эмфиземой легких, при развитии резко выраженных и прогрессирующих вентиляционных нарушений.
Среди причин развития артериальной гипоксемии ведущую роль играет вентиляционно-перфузионные нарушения. Другой причиной возможного развития гипоксемии является нарушение условий диффузии O 2 в легких. В качестве третьего возможного механизма артериальной гипоксемии может быть внутрилегочное шунтирование сосудов малого и большого кругов кровообращения.
Для того чтобы легкие человека могли нормально работать, необходимо соблюдение нескольких важных условий. Во-первых, возможность свободного прохождения воздуха по бронхам до самых маленьких альвеол. Во-вторых, достаточное количество альвеол, которые могут поддерживать газообмен и в-третьих, возможность увеличения объёма альвеол во время акта дыхания.
По классификации принято выделять несколько типов нарушения вентиляции легких:
- Рестриктивный
- Обструктивный
- Смешанный
Рестриктивный тип связан с уменьшением объёма легочной ткани, что случается при следующих заболеваниях: плеврит, пневмофиброз, ателектаз и других. Возможны также внелегочные причины нарушения вентиляции.
Обструктивный тип связан с нарушением проводимости воздуха по бронхам, что может случиться при бронхоспазме или при другом структурном поражении бронха.
Смешанный тип выделяют при сочетании нарушений по двум вышеуказанным типам.
Способы
диагностики нарушения вентиляции легких
Для диагностики нарушения вентиляции легких по тому или иному типу проводят целый ряд исследований для оценки показателей (объёма и ёмкости), которые характеризуют вентиляцию легких. Прежде чем остановиться подробнее на некоторых исследованиях, рассмотрим эти основные параметры.
- Дыхательный объём (ДО) – количество воздуха, которое поступает в легкие за 1 вдох при спокойном дыхании.
- Резервный объём вдоха (РОвд) – такой объём воздуха, который можно максимально вдохнуть после спокойного вдоха.
- Резервный объём выдоха (РОвыд) – количество воздуха, которое можно дополнительно выдохнуть после спокойного выдоха.
- Емкость вдоха – определяет способность легочной ткани к растяжению (сумма ДО и РОвд)
- Жизненная емкость легких (ЖЕЛ) - объём воздуха, который можно максимально вдохнуть после глубокого выдоха (сумма ДО, РОвд и РОвыд).
А также ряд других показателей, объёмов и емкостей, на основании которых доктор может сделать вывод о нарушении вентиляции легких.
Спирометрия
Спирометрия – такой вид исследования, который основывается на выполнении ряда дыхательных тестов при участии пациента, для того чтобы оценить степень различных легочных расстройств.
Цели и задачи спирометрии:
- оценка степени тяжести и диагностика патологии легочной ткани
- оценка динамики заболевания
- оценка эффективности используемой терапии заболевания
Ход процедуры
Во время выполнения исследования пациент в положении сидя вдыхает и выдыхает воздух с максимальной силой в специальный аппарат, кроме этого фиксируются показатели вдоха и выдоха при спокойном дыхании.
Все эти параметры регистрируются с помощью компьютерных устройств на специальной спирограмме, которую расшифровывает доктор.
На основании показателей спирограммы можно определить, по какому типу - обструктивному или рестриктивному, произошло нарушение вентиляции легких.
Пневмотахография
Пневмотахография – метод исследования, при котором записывают скорость движения и объёма воздуха на вдохе и выдохе.
Запись и интерпретация этих параметров позволяет выявить заболевания, которые сопровождаются нарушением проходимости бронхов на ранних стадиях, например бронхиальную астму, бронхоэктатическую болезнь и другие.
Ход процедуры
Пациент сидит перед специальным прибором, к которому его подключают при помощи загубника, как и при спирометрии. Затем пациент делает несколько последовательных глубоких вдохов и выдохов и так несколько раз. Датчики регистрируют эти параметры и строят специальную кривую, на основании которой у пациента выявляют нарушения проводимости по бронхам. Современные пневмотахографы помимо этого оснащены различными устройствами, с помощью которых можно регистрировать дополнительные показатели функции дыхания.
Пикфлоуметрия
Пикфлоуметрия - метод, с помощью которого определяют, с какой скоростью пациент может выдохнуть. Этот способ применяется для того, чтобы оценить насколько сужены воздухоносные пути.
Ход процедуры
Пациент в положении сидя выполняет спокойный вдох и выдох, после этого глубоко вдыхает и максимально выдыхает воздух в загубник пикфлоуметра. Через несколько минут он повторяет эту процедуры. Затем происходит запись максимального из двух значений.
КТ
легких и средостения
Компьютерная томография легких – метод рентгенологического исследования, который позволяет получить послойные срезы-картинки и на их основе создать объёмное изображение органа.
С помощью этой методики можно провести диагностику таких патологических состояний как:
- хроническая эмболия легких
- профессиональные заболевания легких, связанные с вдыханием частиц угля, кремния, асбеста и других
- выявить опухолевые поражения легких, состояние лимфатических узлов и наличие метастазов
- выявить воспалительные заболевания легких (пневмония)
- и многие другие патологические состояния
Бронхофонография
Бронхофонография – метод, который основан на анализе дыхательных шумов, записанных во время дыхательного акта.
Когда меняется просвет бронхов или упругость их стенок, тогда нарушается бронхиальная проводимость и создается турбулентное движение воздуха. В результате этого образуются различные шумы, которые можно зарегистрировать с помощью специальной аппаратуры. Такой способ часто применяют в детской практике.
Кроме всех вышеперечисленных методов для диагностики нарушения вентиляции легких и причин, которые вызвали эти нарушения, используют также бронходилатационные и бронхопровокационные тесты с различными препаратами, исследование состава газов в крови, фибробронхоскопию, сцинтиграфию легких и другие исследования.
Лечение
Лечение таких патологических состояний решает несколько основных задач:
- Восстановление и поддержка необходимой для жизни вентиляции легких и оксигенации крови
- Лечение болезни, которая явилась причиной развития нарушения вентиляции (пневмония, инородное тело, бронхиальная астма и другие)
Если причиной послужили инородное тело или закупорка бронха слизью, то эти патологические состояния достаточно просто устранить с помощью фибробронхоскопии.
Однако более частыми причинами такой патологии являются хронические заболевания легочной ткани, например хроническая обструктивная болезнь легких, бронхиальная астма и другие.
Такие заболевания лечатся длительно с применением комплексной медикаментозной терапии.
При выраженных признаках кислородного голодания проводят кислородные ингаляции. Если пациент дышит самостоятельно, то при помощи маски или носового катетера. Во время коматозного состояния выполняется интубация и искусственная вентиляция легких.
Помимо этого выполняются различные мероприятия для улучшения дренажной функции бронхов, например антибиотикотерапия, массаж, физиотерапия, лечебная физкультура при отсутствии противопоказаний.
Грозным осложнением многих нарушений является развитие дыхательной недостаточности различной степени тяжести, которая может приводить к летальному исходу.
Для того чтобы предупредить развитие дыхательной недостаточности при нарушениях вентиляции легких, необходимо попытаться во время диагностировать и устранить возможные факторы риска, а также держать под контролем проявления уже имеющейся хронической патологии легких. Только своевременная консультация специалиста и грамотно подобранное лечение поможет избежать негативных последствий в будущем.
Вконтакте
К дефектам вентиляции легких и возникновению недостаточности дыхания могут приводить разного рода хронические и острые патологии бронхолегочной системы (пневмония, бронхоэктатическая болезнь, ателектаз, дессиминированные процессы в легком, кавернозные полости, абсцессы и пр.), анемия, поражения нервной системы, гипертензия малого круга кровообращения, опухоли средостения и легких, сосудистые заболевания сердца и легких и т. п.
В этой статье рассмотрен рестриктивный тип дыхательной недостаточности.
Описание патологии
Для рестриктивной дыхательной недостаточности характерно ограничение способности ткани легкого к спаданию и расширению, что наблюдается при пневмотораксе, экссудативном плеврите, спаечном процессе в полости плевры, пневмосклерозе, ограниченной подвижности каркаса ребер, кифосколиозе и др. Недостаточность дыхания при таких патологиях возникает из-за ограничения глубины вдоха, которая максимально возможна.
Формы
Рестриктивная обусловлена дефектами альвеолярной вентиляции по причине ограниченности растяжения легких. Выделяются две формы вентиляционной недостаточности дыхания: легочная и внелегочная.
Рестриктивная внелегочная вентиляционная недостаточность дыхания развивается из-за:

Причина
Причины рестриктивной дыхательной недостаточности должен устанавливать врач. Рестриктивная легочная вентиляционная недостаточность дыхания развивается по причине снижения растяжимости легких, которое наблюдается при застойных и воспалительных процессах. Легочные капилляры, переполненные кровью, и интерстициальная отечная ткань мешают альвеолам в полной мере расправиться, сдавливают их. Кроме того, в этих условиях уменьшается растяжимость интерстициальной ткани и капилляров.
Симптомы
Рестриктивная форма дыхательной недостаточности отличается рядом симптомов.
- Снижение показателей легочной емкости в целом, их остаточного объема, ЖЕЛ (данный показатель отражает уровень легочной рестрикции).
- Дефекты регуляторных механизмов появляются также из-за нарушений функционирования дыхательного центра, а также его эфферентных и афферентных связей.
- Проявление альвеолярной рестриктивной гиповентиляции. Клинически значимыми формами являются затрудненное и апнейстическое дыхание, а также его периодические формы.
- Обусловленное предыдущей причиной и дефектами физико-химического мембранного состояния расстройство трансмембранного ионового распределения.
- Колебания нейронной возбудимости в дыхательном центре и, как следствие, - изменения глубины и частоты дыхания.
- Расстройства внешней дыхательной центральной регуляции. Самые частые причины: новообразования и травмы в продолговатом (при воспалении или отеке, кровоизлияниях в мозговое вещество или желудочки), интоксикация (к примеру, наркотическими препаратами, этанолом, эндотоксинами, которые образуются при недостаточности печени или уремии), эндотоксинами, деструктивные трансформации мозговой ткани (к примеру, при сифилисе, сирингомиелии, рассеянном склерозе и энцефалитах).

- Дефекты афферентной регуляции деятельности дыхательного центра, которые проявляются избыточной или недостаточной афферентацией.
- Дефицит возбуждающей афферентации альвеолярной рестриктивной гиповентиляции. Уменьшение тонической неспецифической активности нейронов, расположенных в ретикулярной формации мозгового ствола (приобретенное или наследуемое, к примеру, при передозировке барбитуратов, наркотических анальгетиков, транквилизаторов и прочих психо- и нейроактивных веществ).
- Чрезмерная возбуждающая афферентация альвеолярной рестриктивной гиповентиляции. Признаки следующие: учащенное то есть тахипнож, ацидоз, гиперкапния, гипоксия. Каков еще патогенез рестриктивной дыхательной недостаточности?
- Чрезмерная тормозящая афферентация альвеолярной рестриктивной гиповентиляции. Самые частые причины: повышенное раздражение слизистых системы (при вдыхании человеком раздражающих веществ, к примеру, нашатырного спирта, при остром трахеите и/или бронхите во время вдыхания горячего или холодного воздуха, сильная боль в дыхательных путях и/или в грудной клетке (к примеру, при плевритах, ожогах, травме).
- Дефекты нервной эфферентной дыхательной регуляции. Могут наблюдаться из-за повреждений на тех или иных уровнях эффекторных путей, которые регулируют функционирование дыхательных мышц.
- Дефекты кортико-спинальных путей к мышцам дыхательной системы (к примеру, при сирингомиелии, ишемии спинного мозга, травме или опухолях), что приводит к утере осознанного (произвольного) контроля дыхания, а также переходу на «стабилизированное», «машинообразное», «автоматизированное» дыхание.

- Поражения путей, проводящие к диафрагме от дыхательного центра (к примеру, при травме спинного мозга или ишемии, полиомиелите или рассеянном склерозе), которые проявляются потерей дыхательного автоматизма, а также переходом на дыхание произвольного типа.
- Дефекты спинальных нисходящих путей, нервных стволов и мотонейронов спинного мозга к дыхательной мускулатуре (к примеру, при ишемии спинного мозга или травме, ботулизме, полиомиелите, блокаде проводимости нервов и мышц при использовании лекарств кураре и миастении, невритах). Симптомы следующие: уменьшение амплитуды движений дыхания и апноэ периодического характера.
Отличие рестриктивной от обструктивной дыхательной недостаточности
Обструктивная дыхательная недостаточность, в отличие от рестриктивной, наблюдается при затрудненном прохождении воздуха по бронхам и трахее по причине бронхоспазма, бронхита (воспаления бронхов), проникновения инородных тел, сдавления трахеи и бронхов опухолью, сужения (стриктуры) бронхов и трахеи и т. п. При этом нарушаются функциональные возможности дыхания внешнего: полный вдох и в особенности выдох затрудняются, частота дыхания ограничивается.
Диагностика
Рестриктивную дыхательную недостаточность сопровождают ограниченность наполнения воздухом легких из-за снижения дыхательной легочной поверхности, выключение из дыхания части легкого, уменьшение эластических характеристик грудной клетки и легкого, а также способности ткани легкого к растяжению (гемодинамический или воспалительный легочный отек, обширные пневмонии, пневмосклероз, пневмокониозы и пр.). В случае, если рестриктивные дефекты не сочетаются с нарушениями проходимости бронхов, которые описаны выше, не возрастает сопротивление путей, несущих воздух.

Главное следствие ограничительных (рестриктивных) вентиляционных расстройств, которые выявляются при спирографии классического вида, - это практически пропорциональное снижение большей части легочных емкостей и объемов: ОФВ1, ДО, ОФВ, ЖЕЛ, РОвыд, РОвд и пр.
Компьютерная спирография показывает, что кривая поток-объем является копией правильной кривой в уменьшенном виде в связи с уменьшением в целом легочного объема, который смещен вправо.
Диагностические критерии
Самые значимые диагностические критерии вентиляционных рестриктивных расстройств, которые позволяют довольно надежно выявить отличия от обструктивных дефектов:

Нужно еще раз отметить, что при диагностических мероприятиях рестриктивных вентиляционных расстройств в чистом виде нельзя опираться лишь на уменьшение ЖЕЛ. Самые надежные диагностико-дифференциальные признаки - это отсутствие трансформаций внешнего вида экспираторного участка кривой поток-объем и пропорциональное снижение РОвыд и РОвд.
Как действовать пациенту?
Если появляются симптомы рестриктивной дыхательной недостаточности, нужно обратиться к терапевту. Может быть, понадобится также консультация специалистов других направлений.
Лечение
Рестриктивные легочные заболевания требуют продолжительной домашней вентиляции легких. Ее задачи при этом следующие:

Чаще всего при проведении продолжительной домашней легочной вентиляции пациенты при рестриктивной дыхательной недостаточности пользуются носовыми масками и портативными респираторами (в некоторых случаях применяется трахеостома), при этом вентиляция делается по ночам, а также несколько часов днем.
Вентиляционные параметры обычно выбираются в стационарных условиях, а затем осуществляется регулярное наблюдение за больным и обслуживание специалистами аппаратуры на дому. Чаще всего при проведении продолжительной легочной вентиляции на дому пациентам с дыхательной недостаточностью хронического характера требуется подача кислорода из резервуаров с жидким кислородом или из кислородного концентратора.
Вот мы и рассмотрели рестриктивный и обструктивный типы дыхательной недостаточности.
Для цитирования:
Шилов А.М., Мельник М.В., Чубаров М.В., Грачев С.П., Бабченко П.К. Нарушения функции внешнего дыхания у больных с хронической сердечной недостаточностью // РМЖ. 2004. №15. С. 912
Сердечная недостаточность (СН) - неспособность сердца, как насоса, перекачивать объем крови (МОС л/мин), необходимый для метаболических нужд организма (обеспечение основного обмена). Снижение насосной способности сердца ведет к развитию гипоксемии - раннему и постоянному признаку недостаточности кровообращения, лежащей в основе клинических признаков СН. Выраженность центральной и периферической гипоксемии обусловлены кардиогенной дыхательной недостаточностью, как следствием застоя в малом круге кровообращения при левожелудочковой недостаточности, так и периферическими циркуляторными расстройствами в результате снижения МОС (рис. 1).
Циркуляторная гипоксемия манифестируется цианозом (увеличение восстановленного гемоглобина), в результате увеличения артерио-венозной разницы по кислороду за счет снижения скорости периферического кровотока для максимальной передачи тканям кислорода, как первоисточника аэробного окислительного фосфорилирования в митохондриях клеток различных органов.
Кардиогенная дыхательная недостаточность - результат вовлечения легкого в патологический процесс при несостоятельности насосной функции сердца, что ведет к ретроградному повышению давления в левом предсердии и облигатно - к повышению давления в сосудах малого круга кровообращения, формируя капиллярную пассивную легочную гипертензию. В соответствии с уравнением Старлинга - при повышении гидростатического давления в малом круге кровообращения происходит увеличение скорости фильтрации жидкости через микрососудистый эндотелий в легочный интерстиций. Когда жидкость фильтруется быстрее, чем удаляется лимфатической системой, происходит развитие периваскулярного интерстициального, а затем и альвеолярного отека легкого, что усугубляет газообменную функцию легочной ткани (рис. 2). На первом этапе компенсации при повышении интерстициального давления происходит стимуляция J-рецепторов с увеличением объема вентиляции, что способствует увеличению лимфооттока и, как следствие, минимизирует риск прогрессирующего внутритканевого отека и последующегоальвеолярного наводнения . С механической точки зрения задержку жидкости в малом круге кровообращения можно представить, как рестриктивные расстройства, проявляющиеся изменением легочных объемов, уменьшением эластических свойств легочной ткани за счет отека интерстиции, наводнения альвеол - функциональных единиц, что суммарно приводят к снижению газообменной функции легкого . Прогрессивное уменьшение емкости легкого и его растяжимости вызывает рост отрицательного давления в плевральной полости, необходимого для осуществления вдоха, а следовательно, усиление работы дыхания, увеличивая долю от минутного объема сердца, необходимую для энергетического обеспечения механики дыхания. Одновременно рядом исследователей показано, что застой в легком способствует увеличению сопротивления в дистальных дыхательных путях, за счет отека слизистой бронхов и повышение их чувствительности к бронхоконстрикторным стимулам вегетативной нервной системы через ионно-кальцевый механизм на фоне внутриклеточного дефицита магния (рис. 3.) . Согласно «ионно-кальцевой» гипотезе, механизм бронхиальной обструкции «запускается» через нарушение кальциевого обмена, являющегося «триггером» высвобождения биохимических медиаторов. Раздражение дыхательных путей химическими и фармакологическими веществами ведет к повышению концентрации кальция в цитозолях тучных клеток, базофилов, клеток гладкой мускулатуры бронхов и нервных окончаниях вегетативной нервной системы (в частности, «блуждающего» нерва). В результате этого происходит высвобождение гистамина из тучных клеток, сокращение гладких мышц бронхов, увеличение ацетилхолина в нервных окончаниях, что вызывает усиление бронхоспазма и секреции слизи эндотелием бронхов . По данным различных авторов, у 40-60% пациентов с различной бронхобструктивной патологией отмечается внутриклеточный дефицит магния (среди пациентов, находящихся в блоках интенсивной терапии - до 70%) . В организме человека магний является четвертым, а в клетке - вторым (после калия) по концентрации катионом. Внутриклеточный и внеклеточный магний участвует в регуляции концентрации и перемещении ионов кальция, калия, натрия, фосфатов как внутри клетки, так и вне ее. Одновременно магний в качестве кофактора активизирует более 300 энзимных реакций, участвующих в метаболических процессах организма . Магний взаимодействует с клеточными липидами, обеспечивает целостность клеточной мембраны, вступает в конкурентное соотношение с кальцием на сократительных элементах клеток (подавляет взаимодействие актиновых и миозиновых нитей), в митохондриях - усиление процессов окислительного фосфорилирования. Внутриклеточный гомеокинез электролитов (натрий, калий, кальций и т.д.) контролируется магнием через активацию Na - K - Ca -АТФазу, которая является составной частью клеточной и саркоплазматической мембраны (Са-насос). На работу сарколемального Na-K-насоса и Са-насоса саркоплазматического ретикулума затрачивается 30-40% фосфатной энергии, вырабатываемой в митохондриях за счет аэробного окислительного фосфорилирования. Снижение внутриклеточной концентрации магния приводит к нарушению работы ионных каналов и кальциевого насоса, нарушению внутриклеточного электролитного баланса в пользу избыточного увеличения кальция внутри клетки, что ведет к усилению взаимодействия сократительных элементов гладкой мускулатуры бронхов и угнетению окислительного фосфорилирования в митохондриях. Параллельно с нарушением указанных процессов дефицит магния способствует снижению синтеза белков (подавление внутриклеточной репарации) . В 1912 г. Trendelenburg в опытах с изолированными легкими коров продемонстрировал релаксирующее влияние ионов магния на гладкомышечные волокна бронхов. Аналогичные результаты были получены в экспериментах на морских свинках и крысах в исследованиях Hanry (1940) и Bois (1963) . Подобный бронходилатирующий эффект препаратов магния у больных с различными формами бронхообструкции были получены в клинической практике . Последние десятилетия клинической практики характеризуются интенсивным изучением роли дефицита магния в патогенезе изолированных сердечно-сосудистых заболеваний и в сочетании с легочной патологией ведущих к развитию различной степени тяжести СН. Накопленный опыт клинических исследований свидетельствует, что в 40-70% наблюдений за больными с СС и легочной патологией имеет место дефицит магния - природного и физиологичного антагониста кальция . При изучении патогенеза развития ХСН различного генеза клиницисты традиционно акцентируют внимание на нарушения центральной и периферической гемодинамики, не учитывая роль гипоксемии в развитии клинических признаков СН, вызванной обструктивным и рестриктивным повреждениями легкого при нарушении насосной деятельности сердца . Все вышеизложенное послужило поводом изучения функции внешнего дыхания у больных ХСН различного генеза, результаты которого представлены в данной работе.
Материал и методы исследования
Было обследовано 100 человек: 20 практически здоровых людей - контрольная группа, 40 больных ИБС и 40 больных ХОБЛ с различной степенью ХСН. Степень сердечной недостаточности и ее функциональный класс (растояние в метрах в течение 6 минут ходьбы) определяли согласно классификации, предложенной Обществом специалистов по сердечной недостаточности (ОССН) в 2001 г. . Диагноз ХОБЛ ставился на основании предложений, представленных программой «GOLD» в 2001 г. . ХОБЛ диагносцировали при наличии кашля с выделением мокроты на протяжении трех месяцев неоднократно в течение двух лет анамнеза заболевания, с наличием факторов риска, способствующих развитию этой патологии (курение, частые респираторные инфекции в детском и юношеском возрасте) . Контрольная группа - 20 пациентов, практически здоровые люди в возрасте от 45 до 58 лет (средний возраст 54,4±2,1 лет) - 14 мужчин и 6 женщин. Исследуемая группа 1 - 40 больных ИБС: с атеросклеротическим (29 пациентов) или постинфарктным кардиосклерозом (11 пациентов) в возрасте от 50 до 65 лет (средний возраст- 58,6±4,1 лет), из них 31 мужчина, 9 женщин. В исследование были включены больные с II А и с II Б ст., II-III ФК ХСН. В целом по исследуемой группе с II А ст. было 24 больных, с II Б ст. - 16 больных. Исходно ФК ХСН определяли нагрузочной пробой - расстояние, проходимое обычным шагом за 6 минут до появления одышки: II ФК - от 300, но не более 425 метров; III ФК - от 150, но не более 300 метров Исследуемая группа 2 - 40 больных ХОБЛ 1-2 стадии (по данным спирографии) в сочетании с различными формами ИБС вне периода воспаления со стороны бронхо-легочной системы и ХСН в возрасте от 50 до 60 лет (средний возраст - 57,7±3,9 лет), из них - 28 мужчин, 12 женщин. В целом в исследуемой группе 2 с ХСН II А ст. было 22 пациентов, с II Б ст. - 18 пациентов. Среди пациентов ХОБЛ сопутствующая ИБС - у 13 больных в виде постинфарктного кардиосклероза (32,5%), у 27 (67,5%) - атеросклеротический кардиосклероз. Длительность курения у 35 больных ХОБЛ (87,5%) в среднем составила 24,5±4,1 года. Всем больным, включенным в программу исследования, проводилось ЭКГ, ЭхоКГ, Р-графическое, спирометрическое исследования и оценка кислотно-щелочного баланса крови до начала лечения и перед выпиской из стационара после проведенного лечения. Средняя длительность пребывания в стационаре составила 21,4±2,7 дней. Больные исследуемой группы 1 (ИБС с ХСН) на фоне стандартной терапии (иАПФ, антиагреганты) получали в стационаре сердечные гликозиды: на первом этапе - первые 2-3 дня внутривенную инфузию оуабаина 0,5 мл в сутки, затем до выписки - дигоксин по 0,125 мг 1-2 раза в день (20 пациентов - подгруппа А). У 20 пациентов ИБС с ХСН (подгруппа Б) к указанной терапии добавляли препараты магния: Кормагнезин 10% 2 г в сутки внутривенно, затем Магнерот - 1-2 г в сутки перорально. Больные исследуемой группы 2 (ХОБЛ с ХСН) получали плановую терапию, включающую отхаркивающие и гипосенсибилизирующие препараты, муколитики с добавлением сердечных гликозидов по вышеописанной методике (20 пациентов - подгруппа А). У 20 больных ХОБЛ с ХСН (подгруппа Б) к плановой терапии добавляли препараты магния - природный антагонист кальция. В группе больных ХОБЛ? 2-агонисты (формотерол) отменяли за два дня до включения в программу исследования. В зависимости от программы лечения больные исследуемой (ИБС с ХСН) и группы сравнения (ХОБЛ с ХСН) были распределены на две подгруппы в равных количествах по 20 пациентов: подгруппа А - лечение без препаратов магния, подгруппа Б - лечение с добавлением препаратов магния (Кормагнезин 10% 20 мл в/в, Магнерот в таблетках) (табл. 1). Исследование функции внешнего дыхания у больных с СН проводилось с целью выявления особенностей характера изменений механики дыхания легкого при ИБС и ХОБЛ, результаты которых представлены в таблице 2. Как видно из таблицы, у больных ИБС и ХОБЛ, осложненных СН, имеет место снижение статических (ЖЕЛ л) и динамических (ФЖЕЛ, ОФВ1, л) объемов легкого по сравнению с контрольной группой: в группе больных ИБС ЖЕЛ, ФЖЕЛ, ОФВ1 соответственно снижены на 48,4%, 46,5% и 48,3% (р<0,01); в группе больных ХОБЛ - на 26,5%, 59% и 61,4% соответственно (р<0,001). Более выраженное снижение ЖЕЛ у больных ИБС, осложненной СН, свидетельствует о преимущественнорестриктивном характере патологии (застой в малом круге кровообращения). При анализе показателей, характеризующих проходимость воздухоносных путей, выявлена следующая особенность: в группе больных ИБС ОФВ1/ФЖЕЛ %, МОС 25-75 и ПСВ снижены соответственно на 3,2%, 4,3% и 13,8% (статистически достоверно по первому порогу вероятности безошибочного прогноза - р<0,05) по сравнению с контрольной группой; в группе больных ХОБЛ аналогичные параметры снижены на 6,1%, 39,2% и 37,8% соответственно (р<0,05±0,01). Данные показатели исследования свидетельствуют о преимущественном обструктивном характере повреждения крупных воздухоносных путей у больных ХОБЛ (МОС 25-75, л/с снижен на 39,2%), в то время как у больных ИБС нарушение функции внешнего дыхания носит смешанный характер - рестриктивно-обструктивный с преимущественным включением мелких бронхов (ЖЕЛ уменьшена на 26,5%, ОФВ1/ФЖЕЛ% снижено на 3,2%). В таблице 3 представлены результаты исходного исследования газового состава и кислотно-щелочного баланса крови в контрольной и группах больных ИБС и ХОБЛ с СН. Как видно из таблицы, не отмечается статистически достоверного различия в кислородо-транспортной функции крови между контрольной и группами обследуемых больных: Hb в контрольной группе - 134,6±7,8 г/л, в группе больных ИБС - 129,4±8,1 г/л, в группе больных ХОБЛ - 138,6±6,8 (р>0,05). Среди изучаемых групп больных также не получено статистически достоверной разницы по газовому составу артериальной крови (р>0,05). Выявлена статистически достоверная разница по газовому составу венозной крови между контрольной и группой обследуемых больных: парциальное давление кислорода венозной крови - РвО2 мм рт.ст. в группе больных ИБС уменьшено по отношению к контрольной группе на 35,8%, в группе больных ХОБЛ - на 17,6% (р<0,01); парциальное давление углекислого газа - РвСО2 мм рт.ст. увеличено в группе больных ИБС на 10,7%, в группе больных ХОБЛ - на 12,1% (p<0,05). Насыщение и концентрация кислородом венозной крови значительно уменьшены у больных ИБС и ХОБЛ по отношению к контрольной группе: SO2% вен. и КО2 вен. мл/дл в группе больных ИБС снижены соответственно на 43,2% и на 44,7%; в группе больных ХОБЛ - на 40,9% и на 38,8% соответственно (р<0,01). В наших исследованиях функции внешнего дыхания и газового состава артериальной и венозной крови, ЦГ до лечения у больных ИБС (40 пациентов) и ХОБЛ (40 больных), осложненных СН, согласно стадийной классификации ХСН и ФК были получены следующие результаты: - у больных ИБС до лечения нарушения функции внешнего дыхания носят смешанный характер, с преимущественным рестриктивным (застой) поражением легкого; - у больных ХОБЛ нарушения функции внешнего дыхания до лечения также имеют сочетанный характер, но преимущественно с обструктивными процессами в дыхательных путях легкого. Данные выводы основаны на результатах исследования статических, динамических объемов легкого и параметров проходимости крупных и мелких бронхов дыхательных путей: так, в группе больных ИБС ЖЕЛ и ФЖЕЛ были снижены по отношению к контрольным величинам (контрольная группа здоровых - 20 пациентов) на 48,4%, 46,5% соответственно (р<0,001), что указывает на рестриктивную патологию, вызванную застоем крови в легком; ОФВ1С, МОС 25-75 и ПСВ, характеризующие сопротивление мелких и средних бронхов (обструкция), снижены соответственно на 48,3% (р<0,001), 4,3% (р<0,05) и на 13,8% (р<0,01). Констрикция дыхательных путей в данной группе пациентов носит доклинический характер, что манифестируется отсутствием сухих хрипов на выдохе. В группе больных ХОБЛ аналогичные показатели функции внешнего дыхания: ЖЕЛ и ФЖЕЛ снижены по отношению к контрольной группе соответственно на 57,2%, 59% (р<0,01); ОФВ1С, МОС 25-75 и ПСВ л/с уменьшены соответственно на 51,4%, 39,2 и на 37,8% (p<0,01). Более выраженные изменения указанных параметров функционального состояния органов дыхания в данной группе больных, по сравнению с больными ИБС, свидетельствуют не только о застойном характере, но и документируют структурное повреждение легкого вследствие предшествующих воспалительных процессов. Нарушение насосной функции сердца, соответствующее IIА-Б стадиям и 2ФК ХСН в группах больных ИБС и ХОБЛ подтверждается снижением ФВ% по отношению к контрольной группе на 29,1%, 27,7% соответственно (р<0,01), со статистически достоверным уменьшением толерантности к физической нагрузке (ходьба 6 минут) на 39,6% в группе больных ИБС и на 41,3% в группе больных ХОБЛ (р<0,01). При анализе газового состава артериальной и венозной крови у больных ИБС и ХОБЛ с СН до лечения по сравнению с контрольной группой выявлены два компонента гипоксемии: кардиогенная дыхательная недостаточность (застой в малом круге кровообращения, обструкция воздухоносных путей) и нарушения периферического кровообращения в результате нарушения насосной функции сердца. Кардиогенная дыхательная недостаточность вследствие застоя в малом круге кровообращения и нарушения газообменной функции легкого, проявляется в наших исследованиях в виде статистически достоверного снижения оксигенации артериальной крови - PаО2 в группе больных ИБС на 15,9% (р<0,01), в группе больных ХОБЛ - на 9,7% (р<0,05) по сравнению с контрольной группой пациентов. Более выраженная разница снижения насыщения артериальной крови в группе больных ИБС по сравнению с больными ХОБЛ, возможно, вызвана большим накоплением жидкости в интерстиции легкого, снижающей диффузию кислорода, в то время как правожелудочковая недостаточность при ХОБЛ частично «разгружает» малый круг кровообращения.
Циркуляторный компонент гипоксемии , как результат компенсаторного замедления периферического кровотока при СН с целью более эффективной отдачи кислорода периферическим тканям, в группе больных ИБС проявляется увеличением КЭО2 на 119,3%, Grad АВ О2 - на 155,8% (р<0,001) и снижением PвО2 - на 25,8% (р<0,01); в группе больных ХОБЛ: КЭО2 увеличен на 111,2%, Grad АВ О2 - на 156,9% (р<0,01), PвО2 - снижен на 17,6% (р<0,01) по сравнению с контрольной группой.
Результаты лечения
Улучшение насосной функции сердца способствует уменьшению застоя крови в легком со снижением рестриктивного повреждения, что подтверждается в наших исследованиях увеличением статических и динамических объемов легкого у обследуемых больных ИБС и ХОБЛ с СН к моменту выписки из стационара. В подгруппе А больных ИБС к моменту выписки из стационара произошло статистически достоверное увеличение ЖЕЛ на 12,7%, ФЖЕЛ - на 14% ,ОФВ1 - на 15,5% (p<0,01), в то время как проходимость бронхиальных путей практически осталась на исходном уровне, что указывает на устранение рестриктивного компонента нарушения функции внешнего дыхания, за счет уменьшения застоя в малом круге кровообращения. В подгруппе Б (гликозиды с препаратами магния) одновременно с увеличением ЖЕЛ на 31%, ФЖЕЛ - на 23,7%, ОФВ1 - на 30,3% (p<0,001), зарегистрированыувеличения ОФВ1/ФЖЕЛ на 5,5%, МОС 25-75 - на 6,2%, ПСВ - на 4,5% (р<0,05), что указывает на устранение бронхоспастического компонента за счет бронходилатационного действия магния (рис. 1). У больных ХОБЛ в подгруппе А также отмечено увеличение исследуемых объемов легкого: ЖЕЛ увеличилась на 8,4%, ФЖЕЛ - на 15,4%, ОФВ1 - на 14,9% (р<0,01), без динамики со стороны параметров проходимости верхних дыхательных путей. В подгруппе Б больных ХОБЛ к моменту выписки из стационара (гликозиды, препараты магния) с одновременным увеличением объемов легкого (ЖЕЛ увеличилась на 19,5%, ФЖЕЛ - на 29%, ОФВ1 - на 40,5% , р<0,001) отмечено статистически достоверное улучшение проходимости бронхов: ОФВ1/ФЖЕЛ увеличилось на 8,3%%, МОС 25-75 - на 28,6%, ПСВ - на 34,2% (р<0,01), что также подтверждает бронходилатирующий эффект препаратов магния. Как видно из рисунка 1, наилучший терапевтический эффект в показателях функции внешнего дыхания был достигнут у больных ХОБЛ, где в программу лечения СН были добавлены препараты магния, за счет устранения бронхообструктивного и рестриктивного (застой) компонентов. Компенсация нарушенных функций насосной деятельности сердца и внешнего дыхания суммарно привели к улучшению газового состава крови. В подгруппах А и Б больных ИБС, при стабильном уровне гемоглобина к моменту выписки из стационара, насыщение артериальной крови - РаО2 соответственно возросло на 12,1% и на 14,9% (р<0,01) с одновременным уменьшением РаСО2 на 8,2%, на 13,6% (р<0,01), что свидетельствует об улучшении газообменной функции легкого. Улучшение периферического кровотока в результате нормализации насосной деятельности сердца в наших исследованиях документируется уменьшением GradАВО2 и КЭО2 в подгруппах А и Б больных ИБС соответственно на 9%-11% и на 25%-26% (р<0,01) (рис. 2). В подгруппах А и Б больных ХОБЛ к моменту выписки из стационара на фоне проведенной терапии отмечена статистически достоверная аналогичная динамика со стороны газового состава артериальной и венозной крови: РаО2 увеличилось на 9,15% и на 15,4% (р<0,01), РаСО2 уменьшилось на 6,1% и на 5,6% (р<0,05); GradАВО2 и КЭО2 соответственно уменьшились на 5%-7% и на 7%-9% (р<0,05) (рис. 3). Более выраженная положительная динамика в газовом составе артериальной и венозной крови получена в подгруппах Б больных ИБС и ХОБЛ на фоне проводимого лечения СН, вследствие суммарного воздействия гликозидов (улучшение насосной функции сердца - положительный инотропный эффект) и препаратов магния (бронходилатирующий и вазодилатирующий эффекты) на дыхательную и СС системы. Улучшение газообменной функции легкого, насосной деятельности сердца, центральной и периферической циркуляции суммарно увеличили толерантность к физической нагрузке у больных ИБС и ХОБЛ к концу пребывания в стационаре: в подгрупах А и Б больных ИБС толерантность к физической нагрузке (количество метров при ходьбе в течение 6 мин) статистически достоверно возросла соответственно на 9% и на 17% (р<0,01), в подгруппах А и Б больных ХОБЛ толерантность к физической нагрузке увеличилась на 14% и 19,7% (р<0,01) (рис. 4). Рисунок 4 наглядно иллюстрирует более высокую терапевтическую эффективность комбинации сердечных гликозидов с препаратами магния за счет их суммарного воздействия на сердечно-легочную системы. В результате проведенного лечения и компенсации дыхательной и сердечной недостаточности в группе больных ИБС клинические признаки IIБ ст СН отсутствовали, в то время как до лечения они имели место в 40% наблюдений, в 50% в целом по всей группе клинические признаки СН были расценены, как I ст. с 1ФК. В группе больных ХОБЛ клинические результаты лечения в виде компенсации кровообращениятакже свидетельствовали об устранении симптомов соответствующих IIБ ст. СН (в 45% наблюдений) до лечения, с переходом в I ст. СН в 47,4% наблюдений. Подобная динамика в стадиях СН явилась результатом улучшения насосной деятельности сердца, улучшения газообменной функции легкого и улучшения периферического кровообращения, что было представлено выше. Таким образом, все вышеизложенное позволяет предположить, что при развитии клинических признаков СН в результате несостоятельности насосной деятельности сердца, необходимо учитывать рестриктивные (застой крови в легком - отек интерстиция и «наводнение» альвеол) и обструктивные (бронхоспазм) компоненты нарушения функции внешнего дыхания, ведущие к снижению газового обмена и кислородо-транспортной роли крови, с нарушениями периферического кровообращения. Выраженность этих нарушений определяет стадии СН и ФК. Включение в программу лечения препаратов магния способствует более эффективному купированию клинических признаков СН с переводом в менее тяжелую стадию СН, за счет удаления застоя в легком и снятия бронхообструкции. Улучшение насосной деятельности сердца, газообменной функции легкого суммарно улучшают периферический кровоток и передачу кислорода перфузируемым органам, что документируется увеличением толерантности к физическим нагрузкам.
Литература
1. Айсанов З.Р., Кокосов А.Н., Овчаренко С.И. и др. Хронические обстру-
ктивные болезни лёгких. Федеральная программа // Consilium
medicum.-2002.-Том 2.-№ 1
2. Беленков Ю.Н. Классификация хронической сердечной недостаточ-
ности // Сердечная Недостаточность.-2001.-Том 2.-№6.-С. 249-250
3. Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармаколо-
гия и фармакотерапия. Глава 14. Лекарственные средства, применяе-
мые при бронхообструктивных заболеваниях лёгких
4. Бессонова Л.О., Хомякова С.Г. Национальный конгресс по болезням
органов дыхания. Москва, 11-15 ноября 2002. Сульфат магния в лече-
нии ХОБЛ у пожилых людей // Пульмонология, 2002
5. Биджани Х., Могадамния А.А., Ислами Халили Е. Внутривенное при-
менение сульфата магния в лечении больных тяжёлой бронхиальной ас-
тмой, не отвечающих на традиционную терапию // Пульмонология 2003,
Том 13, №6
6. Вёрткин А.Л., Вилковысский Ф.А., Городецкий В.В. Применение маг-
ния и оротовой кислоты в кардиологии // Методические рекомендации.
Москва, 1997
7. GOLD - новая международная программа по ХОБЛ // Русский Меди-
цинский Журнал.-2001.-12.-№4.-С.509
8. Дворецкий Л.И. Инфекции и хроническая обструктивная болезнь лёг-
ких // Consilium medicum.-2001.-т. 3-№12.-С. 587-594
9. Овчаренко С.И., Литвинова И.В., Лещенко И.В. Алгоритм лечения
больных хронической обструктивной болезнью лёгких // Русский Меди-
цинский Журнал.-2004
10. Овчаренко С.И., Лещенко И.В. Современные проблемы диагностики
хронической обструктивной болезни лёгких // Русский Медицинский
Журнал.-2003.-Том 11.-№4.-С.160-163
11. Святов И.С. Магний в профилактике и лечении ишемической болез-
ни сердца и её осложнений. Доктор. Диссертация, 1999.
12. Шмелёв Е.И. Хроническая обструктивная болезнь лёгких // Пульмо-
нология, избранные вопросы.-2001.-№2.-С. 1-9
13. Altura BM, Altura BT. Magnesium ions and contraction of vascular
smooth muscle: relationship to some vascular disease. Fed Proc 1981;
40:2672-9
14. Brunner EH, Delabroise AM, Haddad ZH: Effect of parenteral magnesium
on pulmonary function, plasma cAMP and histamine in bronchial asthma. J
Asthma 1985. 22:3-11
15. Buller NP, Poole-Wilson PA. Mechanism of the increased ventilatory
response to exercise in patients with chronic heart failure. Br Heart J
1990;63:281-283
16. Dominguez LJ, Barbagallo M, Di Lorenzo G et al. Bronchial reactivity and
intracellular magnesium: a possible mechanism for the bronchodilating
effects of magnesium in asthma. Clinical Science 1998; 95:137-142
17. Fiaccadori E, Del Canale S, Coffrini E, et al. Muscle and serum magnesium in pulmonary intensive care unit patients. Crit Care Med
1988;16:751-60.
При инструментальной диагностике пульмонологических заболеваний часто исследуется функция внешнего дыхания. Такое обследование включает такие методы, как:
- спирография;
- пневмотахометрия;
- пикфлоуметрия.
В более узком смысле под исследованием ФВД понимают два первых метода, осуществляемых одновременно с помощью электронного аппарата – спирографа.
В нашей статье мы поговорим о показаниях, подготовке к перечисленным исследованиям, интерпретации полученных результатов. Это поможет пациентам с заболеваниями органов дыхания сориентироваться в необходимости той или иной диагностической процедуры и лучше понять полученные данные.
Немного о нашем дыхании
Дыхание –жизненный процесс, в результате которого организм из воздуха получает кислород, необходимый для жизни, и выделяет углекислый газ, образующийся при обмене веществ. Дыхание имеет такие этапы: внешнее (с участием ), перенос газов эритроцитами крови и тканевое, то есть обмен газами между эритроцитами и тканями.
Перенос газов исследуют с помощью пульсоксиметрии и анализа газового состава крови. Об этих методах мы тоже немного поговорим в нашей теме.
Исследование вентиляционной функции легких доступно и проводится практически повсеместно при болезнях органов дыхания. Оно основано на измерении легочных объемов и скорости воздушных потоков при дыхании.
Дыхательные объемы и емкости
Жизненная емкость легких (ЖЕЛ) – наибольший объем воздуха, выдыхаемый после самого глубокого вдоха. Практически этот объем показывает, сколько воздуха может «поместиться» в легкие при глубоком дыхании и участвовать в газообмене. При уменьшении этого показателя говорят о рестриктивных нарушениях, то есть уменьшении дыхательной поверхности альвеол.
Функциональная жизненная емкость легких (ФЖЕЛ) измеряется как и ЖЕЛ, но только во время быстрого выдыхания. Ее величина меньше ЖЕЛ за счет спадения в конце быстрого выдоха части воздухоносных путей, в результате чего некоторый объем воздуха остается в альвеолах «невыдохнутым». Если ФЖЕЛ больше или равна ЖЕЛ, пробу рассматривают как неверно выполненную. Если ФЖЕЛ меньше ЖЕЛ на 1 литр и больше, это говорит о патологии мелких бронхов, которые спадаются слишком рано, не давая воздуху выйти из легких.
Во время выполнения маневра с быстрым выдохом определяют и другой очень важный параметр – объем форсированного выдоха за 1 секунду (ОФВ1). Он снижается при обструктивных нарушениях, то есть при препятствиях для выхода воздуха в бронхиальном дереве, в частности, при и тяжелой . ОФВ1 сравнивают с должной величиной или используют его отношение к ЖЕЛ (индекс Тиффно).
Снижение индекса Тиффно менее 70% говорит о выраженной .
Определяется показатель минутной вентиляции легких (МВЛ) – количество воздуха, пропускаемое легкими при максимально быстром и глубоком дыхании за минуту. В норме оно составляет от 150 литров и больше.
Исследование функции внешнего дыхания
Оно используется для определения легочных объемов и скоростей. Дополнительно нередко назначаются функциональные пробы, регистрирующие изменения этих показателей после действия какого-либо фактора.
Показания и противопоказания
Исследование ФВД проводится при любых болезнях бронхов и легких, сопровождающихся нарушением бронхиальной проходимости и/или уменьшением дыхательной поверхности:
- хронический бронхит;
- и другие.
Исследование противопоказано в следующих случаях:
- дети младше 4 – 5 лет, которые не могут правильно выполнить команды медсестры;
- острые инфекционные заболевания и лихорадка;
- тяжелая стенокардия, острый период инфаркта миокарда;
- высокие цифры артериального давления, недавно перенесенный инсульт;
- застойная сердечная недостаточность, сопровождающаяся одышкой в покое и при незначительной нагрузке;
- психические нарушения, не позволяющие правильно выполнить инструкции.
Функция внешнего дыхания: как проводится исследование
Процедура проводится в кабинете функциональной диагностики, в положении сидя, желательно утром натощак или не раньше чем через 1,5 часа после еды. По назначению врача могут быть отменены , которые постоянно принимает пациент: бета2-агонисты короткого действия – за 6 часов, бета-2 агонисты продленного действия – за 12 часов, длительно действующие теофиллины – за сутки до обследования.

Исследование функции внешнего дыхания
Нос пациенту закрывают специальным зажимом, чтобы дыхание осуществлялось только через рот, с помощью одноразового или стерилизуемого мундштука (загубника). Обследуемый дышит некоторое время спокойно, не заостряя внимания на процессе дыхания.
Затем пациенту предлагают сделать спокойный максимальный вдох и такой же спокойный максимальный выдох. Так оценивается ЖЕЛ. Для оценки ФЖЕЛ и ОФВ1 пациент делает спокойный глубокий вдох и как можно быстрее выдыхает весь воздух. Эти показатели записываются трижды с небольшим интервалом.
В конце исследования проводится довольно утомительная регистрация МВЛ, когда пациент в течение 10 секунд дышит максимально глубоко и быстро. В это время может возникнуть небольшое головокружение. Оно не опасно и быстро проходит после прекращения пробы.
Многим больным назначаются функциональные пробы. Самые распространенные из них:
- проба с сальбутамолом;
- проба с физической нагрузкой.
Менее часто назначается проба с метахолином.
При проведении пробы с сальбутамолом после регистрации исходной спирограммы пациенту предлагают сделать ингаляцию сальбутамола – бета2 агониста короткого действия, расширяющего спазмированные бронхи. Спустя 15 минут исследование повторяют. Также можно применять ингаляцию М-холинолитика ипратропия бромида, в этом случае повторно исследование проводят через 30 минут. Введение можно осуществлять не только с помощью дозированного аэрозольного ингалятора, но в некоторых случаях с использованием спейсера или .
Проба считается положительной при увеличении показателя ОФВ1 на 12% и больше при одновременном увеличении его абсолютного значения на 200 мл и больше. Это означает, что выявленная исходно бронхиальная обструкция, проявившаяся снижением ОФВ1, является обратимой, и после ингаляции сальбутамола проходимость бронхов улучшается. Это наблюдается при .
Если при исходно сниженном показателе ОФВ1 проба отрицательная, это говорит о необратимой бронхиальной обструкции, когда бронхи не реагируют на расширяющие их лекарства. Такая ситуация наблюдается при хроническом бронхите и нехарактерна для астмы.
Если же после ингаляции сальбутамола показатель ОФВ1 уменьшился, это парадоксальная реакция, связанная со спазмом бронхов в ответ на ингаляцию.
Наконец, если проба положительная на фоне исходного нормального значения ОФВ1, это говорит о гиперреактивности бронхов или о скрытой бронхиальной обструкции.
При проведении теста с нагрузкой пациент выполняет упражнение на велоэргометре или беговой дорожке 6 – 8 минут, после чего проводят повторное исследование. При снижении ОФВ1 на 10% и больше говорят о положительной пробе, которая свидетельствует об астме физического усилия.
Для диагностики бронхиальной астмы в пульмонологических стационарах используется также провокационная проба с гистамином или метахолином. Эти вещества вызывают спазм измененных бронхов у больного человека. После ингаляции метахолина проводят повторные измерения. Снижение ОФВ1 на 20% и больше свидетельствует о гиперреактивности бронхов и о возможности бронхиальной астмы.
Как интерпретируются результаты
В основном на практике врач функциональной диагностики ориентируется на 2 показателя – ЖЕЛ и ОФВ1. Чаще всего их оценивают по таблице, предложенной Р. Ф. Клемент и соавторами. Приводим общую таблицу для мужчин и женщин, в которой даны проценты от нормы:
Например, при показателе ЖЕЛ 55% и ОФВ1 90% врач сделает заключение о значительном снижении жизненной емкости легких при нормальной бронхиальной проходимости. Такое состояние характерно для рестриктивных нарушений при пневмонии, альвеолите. При хронической обструктивной болезни легких, напротив, ЖЕЛ может быть, например, 70% (легкое снижение), а ОФВ1 – 47% (резко снижено), при этом проба с сальбутамолом будет отрицательной.
Об интерпретации проб с бронхолитиками, нагрузкой и метахолином мы уже поговорили выше.
Функция внешнего дыхания: еще один способ оценки
Используется и другой способ оценки функции внешнего дыхания. При этом способе врач ориентируется на 2 показателя – форсированной жизненной емкости легких (ФЖЕЛ, FVC) и ОФВ1. ФЖЕЛ определяется после глубокого вдоха при резком полном выдохе, продолжающемся как можно дольше. У здорового человека оба эти показателя составляют более 80% от нормальных.
Если ФЖЕЛ более 80% от нормы, ОФВ1 менее 80% от нормы, а их соотношение (индекс Генцлара, не индекс Тиффно!) менее 70%, говорят об обструктивных нарушениях. Они связаны преимущественно с нарушением проходимости бронхов и процесса выдоха.
Если оба показателя составляют менее 80% от нормы, а их соотношение более 70%, это признак рестриктивных нарушений – поражений самой легочной ткани, препятствующих полному вдоху.
Если значения ФЖЕЛ и ОФВ1 менее 80% от нормы, и их соотношение составляет менее 70%, это комбинированные нарушения.
Чтобы оценить обратимость обструкции, смотрят на величину ОФВ1/ФЖЕЛ после ингаляции сальбутамола. Если она остается менее 70% – обструкция необратимая. Это признак хронической обструктивной болезни легких. Для астмы характерна обратимая бронхиальная обструкция.
Если выявлена необратимая обструкция, необходимо оценить ее тяжесть. для этого оценивают ОФВ1 после ингаляции сальбутамола. При его величине больше 80% от нормы говорят о легкой обструкции, 50 – 79% – умеренной, 30 – 49% – выраженной, менее 30% от нормы – резко выраженной.
Исследование функции внешнего дыхания особенно важно для определения степени тяжести бронхиальной астмы до начала лечения. В дальнейшем для самоконтроля больные с астмой должны дважды в день проводить пикфлоуметрию.
Это метод исследования, помогающий определить степень сужения (обструкции) дыхательных путей. Проводится пикфлоуметрия с помощью небольшого аппарата – пикфлоуметра, оснащенного шкалой и мундштуком для выдыхаемого воздуха. Наибольшее применение пикфлоуметрия получила для .
Как проводится пикфлоуметрия
Каждый больной с астмой должен проводить пикфлоуметрию дважды в день и записывать результаты в дневник, а также определять средние значения за неделю. Кроме того, он должен знать свой лучший результат. Снижение средних показателей свидетельствует об ухудшении контроля за течением болезни и начале обострения. При этом необходимо обратиться к врачу или увеличить , если пульмонолог заранее объяснил, как это сделать.

График ежедневной пикфлоуметрии
Пикфлоуметрия показывает максимальную скорость, достигнутую в течение выдоха, которая хорошо соотносится со степенью бронхиальной обструкции. Проводится она в положении сидя. Сначала пациент спокойно дышит, затем производит глубокий вдох, берет в губы мундштук аппарата, держит пикфлоуметр параллельно поверхности пола и максимально быстро и интенсивно выдыхает.
Процесс повторяется через 2 минуты, затем еще раз через 2 минуты. В дневник записывается лучший из трех показателей. Измерения делаются после пробуждения и перед отходом ко сну, в одно и то же время. В период подбора терапии или при ухудшении состояния можно проводить дополнительное измерение и в дневные часы.
Как интерпретировать данные
Нормальные показатели для этого метода определяются индивидуально для каждого больного. В начале регулярного использования, при условии ремиссии заболевания, находится лучший показатель пиковой скорости выдоха (ПСВ) за 3 недели. Например, он равен 400 л/с. Умножив это число на 0,8, получим минимальную границу нормальных значений для данного пациента – 320 л/мин. Все, что больше этого числа, относится к «зеленой зоне» и говорит о хорошем контроле над астмой.
Теперь умножаем 400 л/с на 0,5 и получаем 200 л/с. Это верхняя граница «красной зоны» – опасного снижения бронхиальной проходимости, когда необходима срочная помощь врача. Значения ПСВ между 200 л/с и 320 л/с находятся в пределах «желтой зоны», когда необходима коррекция терапии.
Эти значения удобно начертить на графике самоконтроля. Так будет хорошо понятно, насколько контролируется астма. Это позволит вовремя обратиться к врачу при ухудшении состояния, а при длительном хорошем контроле позволит постепенно уменьшить дозировку получаемых лекарств (также лишь по назначению пульмонолога).
Пульсоксиметрия помогает определить, сколько кислорода переносится гемоглобином, находящимся в артериальной крови. В норме гемоглобин захватывает до 4 молекул этого газа, при этом насыщение артериальной крови кислородом (сатурация) равно 100%. При снижении количества кислорода в крови сатурация снижается.

Для определения этого показателя применяются небольшие приборы – пульсоксиметры. Они похожи на своеобразную «прищепку», которая надевается на палец. В продаже имеются портативные аппараты этого типа, их может приобрести любой больной, страдающий хроническими легочными заболеваниями, для контроля за своим состоянием. Пульсоксиметры широко используют и врачи.
Когда проводится пульсоксиметрия в стационаре:
- во время кислородной терапии для контроля ее эффективности;
- в отделениях интенсивной терапии при ;
- после тяжелых оперативных вмешательств;
- при подозрении на – периодической остановки дыхания во сне.
Когда можно использовать пульсоксиметр самостоятельно:
- при обострении астмы или другого легочного заболевания, чтобы оценить тяжесть своего состояния;
- при подозрении на ночное апноэ – если пациент храпит, у него имеется ожирение, сахарный диабет, гипертоническая болезнь или снижение функции щитовидной железы – гипотиреоз.
Норма насыщения кислородом артериальной крови составляет 95 – 98%. При снижении этого показателя, измеренного в домашних условиях, необходимо обратиться к врачу.
Исследование газового состава крови
Это исследование проводится в лаборатории, изучается артериальная кровь больного. В ней определяют содержание кислорода, углекислого газа, сатурацию, концентрацию некоторых других ионов. Исследование проводится при тяжелой дыхательной недостаточности, кислородной терапии и других неотложных состояниях, преимущественно в стационарах, прежде всего в отделениях интенсивной терапии.
Кровь берется из лучевой, плечевой или бедренной артерии, затем место пункции придавливается ватным шариком на несколько минут, при пункции крупной артерии накладывается давящая повязка, чтобы избежать кровотечения. Наблюдают за состоянием больного после пункции, особенно важно вовремя заметить отек, изменение цвета конечности; пациент должен сообщить медперсоналу, если у него появится онемение, покалывание или другие неприятные ощущения в конечности.
Нормальные показатели газов крови:
Снижение РО 2 , О 2 СТ, SaO 2 , то есть содержания кислорода, в сочетании с повышением парциального давления углекислого газа может говорить о таких состояниях:
- слабость дыхательных мышц;
- угнетение дыхательного центра при заболеваниях мозга и отравлениях;
- закупорка дыхательных путей;
- бронхиальная астма;
- пневмония;
Снижение этих же показателей, но при нормальном содержании углекислого газа бывает при таких состояниях:
- интерстициальный фиброз легких.
Снижение показателя О 2 СТ при нормальном давлении кислорода и сатурации характерно для выраженной анемии и снижения объема циркулирующей крови.
Таким образом, мы видим, что и проведение этого исследования, и интерпретация результатов довольно сложны. Анализ газового состава крови необходим для принятия решения о серьезных лечебных манипуляциях, в частности, искусственной вентиляции легких. Поэтому делать его в амбулаторных условиях не имеет смысла.
О том, как проводится исследование функции внешнего дыхания, смотрите на видео: