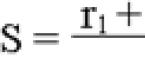Эндогенная интоксикация представляет собой расстройство, базирующееся на структурном нарушении тканей, накоплении отравляющих соединений с дальнейшим развитием клинической картины. Одинаково распространено среди взрослого и детского населения. Имеет собственный код по МКБ, заболевание шифруется в диапазоне Х40–49.
Классификация
Деление патологии зависит от характеристики, взятой за основу. По течению бывает трех типов:
- острое – обладает внезапным началом и бурным развитием;
- подострое – формируется постепенно, лечение занимает более длительный период;
- хроническое – появляется на фоне нарушений, беспокоящих пациента долгое время.
Если ориентироваться на симптоматику эндогенной интоксикации, можно выделить три стадии:

- компенсации – при наличии источника поражения организм с нарушением справляется самостоятельно;
- субкомпенсации – больной предъявляет жалобы на ухудшение самочувствия, так как истощаются естественные биологические механизмы;
- декомпенсации – сопровождается серьезными функциональными расстройствами и глубокими структурными нарушениями тканей, требующими неотложной помощи.
В источниках выделяют развитие эндотоксического шока, клиника которого имеет свое течение и степени.
Особенности патологии
Заболевание основывается на воспалении, в ходе чего наблюдается необратимое изменение работы органов, биохимических процессов. Часто очаг расположен в брюшной полости, черепной коробке, охватывает печень, сердце, почки и головной мозг.

При гистологическом исследовании определяется скопление лейкоцитов, поврежденные клетки и включения, не встречающиеся в норме.
В процессе изучения этиологии расстройства определяются хронические заболевания, травмы, нелеченые долгое время.
Источники внутренней интоксикации
Отравление формируется при постоянной выработке ядовитых веществ, способных дестабилизировать метаболизм в органах, в частности, в печени. К таковым относятся:
- продукты обмена в высоких концентрациях (билирубин, мочевая кислота);
- соединения, появляющиеся при развитии хронических патологий (аммиак, альдегиды);
- элементы, накапливающиеся при нарушении целостности тканей (ферменты, катионы белков);
- вещества, образованные при окислении жирорастворимых соединений.

Особую роль играют заболевания эндокринной системы, при которых в неограниченном количестве продуцируются гормоны – биологически активные вещества, оказывающие прямое или косвенное влияние на жизнедеятельность человека.
Причины отравления организма эндотоксинами
По статистике, расстройство в большей степени встречается в хирургической практике и лечится оперативными методами, что отличает его от экзогенной формы. Этиологическим фактором могут стать:
- ожоги, охватывающие немалый процент тела;
- травмы от длительного сдавления тканей;
- острое воспаление поджелудочной железы с дальнейшим панкреонекрозом;
- перитонит;
- онкология;
- доброкачественные опухоли, продуцирующие гормоны.

Синдром эндогенной интоксикации нередко возникает на фоне трансплантации органов, когда иммунная система отторгает пересаженные ткани, распознавая их как чужеродные.
Механизмы развития
Патогенез сложный в понимании и представлении, служит отражением расстройства микроциркуляции, гипоксии клеток и снижения противоинфекционной защиты, что ухудшает течение отравления.
В медицине выделяют несколько первичных механизмов развития данного заболевания:
- Продукционный. Обусловлен чрезмерным синтезом токсических веществ при острых воспалительных патологиях (перитонит, панкреатит, пневмония).
- Резорбционный. Подразумевает всасывание в общий кровоток соединений, появляющихся в ограниченных очагах тканевого распада, некроза (флегмона, абсцесс, гангрена).
- Реперфузионный. Базируется на поступлении веществ, образовавшихся в локациях, длительно подвергающихся ишемии (свободные радикалы).
- Ретенцидный. Напрямую связан со снижением функциональной активности органов, отвечающих за выведение токсинов (печень, почки).
- Инфекционный. Объясняется извращением качественного и количественного соотношения собственной микрофлоры желудочно-кишечного тракта, в ходе чего бактерии синтезируют в полость органов ядовитые соединения.

Тяжесть течения определяется тремя пунктами: токсемией, выраженностью гипоксии и угнетением работы естественных защитных барьеров.
Клиническая картина
Симптоматика напрямую зависит от стадии эндогенной патологии (острой, подострой, хронической). Что касается первой, то для нее характерны признаки, описанные подробнее ниже в таблице.
| Система | Проявления |
| Пищеварительная | Тошнота |
| Рвота | |
| Метеоризм | |
| Диарея | |
| Запор | |
| Боли в области живота | |
| Нервная | Судороги |
| Тремор конечностей | |
| Спутанность сознания | |
| Психические нарушения | |
| Эмоциональная лабильность | |
| Сердечно-сосудистая | Гипертензия или снижение артериального давления, все зависит от причинного фактора |
| Тахикардия | |
| Кожные покровы | Бледность |
| Испарина | |
| Озноб |
Как и любая интоксикация, отравление данного типа сопровождается лихорадкой, температура тела достигает 39–40 градусов.

При подострой стадии клиника развивается медленно, постепенно, симптомы таковы:
- усталость;
- головокружение;
- снижение или отсутствие аппетита;
- похудание;
- мигрень;
- нарушение сна.
Самой распространенной считается хроническая стадия эндогенного отравления, его особенностями являются:
- ноющие головные боли, интенсивность которых меняется время от времени;
- постепенное снижение массы тела даже при полноценном, высококалорийном питании;
- аритмии;
- эмоциональная нестабильность.
Возможны нарушения со стороны мочевыделительной системы, отмечается недержание урины.
Основные этапы интоксикации
Клиническую картину любой из степеней отравления условно делят на три стадии. Первая именуется как реактивно-токсическая, здесь формируется деструктивный очаг, наблюдается перекисное окисление липидов.
На втором этапе, обозначенном как выраженная токсемия, нарушаются естественные защитные барьеры, ядовитые соединения в высоких концентрациях разносятся по всему организму, на что активно реагирует иммунная система.
Если не предприняты соответствующие врачебные мероприятия, наступает третья стадия – мультиорганная дисфункция. Для нее характерна анурия, паралитическая непроходимость кишечника, спутанность сознания.
Диагностика
В хирургии составлен определенный алгоритм, которого придерживаются все доктора, проводящие обследование больного. План состоит из таких пунктов, как:

- определение убедительных признаков острой, подострой эндогенной интоксикации;
- поставить тяжесть патологическому процессу;
- выявить источник отравления;
- оценить насыщение внутренних сред ядовитыми элементами.
Только потом врач имеет право назначить лечение и отслеживать его эффективность.
Лабораторные маркеры рассматриваемой болезни таковы:
- лейкоцитоз, отклонение от нормы специализированных индексов интоксикации;
- повышенный билирубин, печеночные ферменты;
- снижение общего белка в плазме крови;
- увеличение концентрации мочевины и креатинина;
- измененное соотношение нейтрофилов и лимфоцитов.

В ходе обследования хирург дополнительно выписывает направления на такие инструментальные методы, как:
- МРТ, КТ;
- УЗИ органов брюшной полости, мочеполовой системы, сердца;
- рентгенография интересующего участка тела (с контрастированием и без него);
- электроэнцефалография.
Перечисленные способы диагностики позволяют визуализировать пораженные органы и выявить степень функциональной недостаточности.
Первая помощь
От самого пациента и его близких требуется своевременный вызов бригады СМП, которая доставит пострадавшего в дежурную больницу. Каких-то специфических рекомендаций, способных облегчить состояние человека при эндогенной интоксикации практически не существует.

При ожогах, травмах и острых воспалительных патологиях не нужно давать дополнительных лекарственных средств. Препараты смажут клиническую картину, что затруднит дальнейшую диагностику.
Методы лечения
Терапия требует определенной последовательности действий, зависящей от механизма развития и влияния этиологического фактора. Ее принципы таковы:
- удаление источника;
- стабилизация и усиление работы защитных барьеров;
- увеличение скорости выведения яда;
- угнетение сопутствующей симптоматики.
Что касается первого пункта, то в 80–90% случаев требуется хирургическое вмешательство, подразумевающее иссечение, удаление распавшихся тканей, резекцию органа, введение дренажей.

В послеоперационный период доктор назначает целый комплекс медикаментов с целью коррекции самочувствия пострадавшего. Состоит из следующих компонентов:
- анальгетики;
- спазмолитики или препараты, стимулирующие перистальтику кишечника;
- солевые растворы;
- диуретики;
- иммуномодуляторы;
- коллоиды;
- симптоматические средства, улучшающие пищеварение, дыхание, сердцебиение.
При тяжелом течении эндогенного отравления прибегают к механической очистке крови: гемодиализу, плазмаферезу. При подозрении на присоединение вторичной инфекции врач выписывает антибиотики широкого спектра действия.

Возможные последствия
Осложнения развиваются в том случае, если пациент затянул с лечением, поздно обратился за помощью или врач назначил неадекватную терапию. Прогноз неблагоприятен при развитии:
- почечной, печеночной недостаточности;
- инфекционно-токсического или гиповолемического шока;
- сепсиса;
- комы;
- внутрибольничной пневмонии.
Самым страшным последствием считается летальный исход, наступление смерти зависит от скорости проведения диагностики и терапии.

Профилактика
Для того чтобы избежать формирования эндогенного отравления, нужно лишь своевременно лечить патологии и соблюдать здоровый образ жизни. Особых специфических мероприятий не существует, все зависит от сознательности и заинтересованности самого человека. Пациент должен понимать, что без его желания, сформировавшуюся проблему не решит никто.
Экспертное мнение
Исход патологии зависит от совокупности факторов, основные из которых адекватность терапии, качество проводимой операции, компетентность врача и настрой больного. Часто осложнения формируются не из-за бездарности доктора, а игнорирования медицинских рекомендаций. Надо помнить, что ожог, затронувший высокий процент кожных покровов, большой абсцесс, гангрена сами не рассосутся, а методы народной медицины максимум, что сделают, это снимут клинические проявления на короткий промежуток времени.
 . Эндогенная интоксикация – это синдром в основе которого лежит массивное поступление разнообразных токсинов во внутреннюю среду организма.
. Эндогенная интоксикация – это синдром в основе которого лежит массивное поступление разнообразных токсинов во внутреннюю среду организма.
 В норме за выведение и инактивацию эндогенных токсинов отвечает ряд органов и систем: имунная система, печень и кишечник, почки, лёгкие. При патологии любого из перечисленных органов, другие, нормально функционирующие органы, берут на себя часть его утраченных функций. Это частично компенсирует токсемию, но заставляет их напряжённо работать.
В норме за выведение и инактивацию эндогенных токсинов отвечает ряд органов и систем: имунная система, печень и кишечник, почки, лёгкие. При патологии любого из перечисленных органов, другие, нормально функционирующие органы, берут на себя часть его утраченных функций. Это частично компенсирует токсемию, но заставляет их напряжённо работать.
 При недостаточности одного органа или системы летальность составляет 23 -40%, при недостаточности двух органов – 5360%, трёх и более органов – 73 -89%. Универсальным патогенетическим фактором для такого прогрессирования болезни является эндотоксикоз.
При недостаточности одного органа или системы летальность составляет 23 -40%, при недостаточности двух органов – 5360%, трёх и более органов – 73 -89%. Универсальным патогенетическим фактором для такого прогрессирования болезни является эндотоксикоз.
 Интоксикация– клиническое проявление патологического состояния, возникшего в результате действия на организм веществ эндогенного или экзогенного происхождения. С биохимической точки зрения эндогенная интоксикация - это метаболический ответ организма на любой агрессивный фактор. Токсические вещества или токсины - это соединения различной природы и химического строения, способные при попадании в организм вызывать заболевания или его гибель. Токсемия – наличие токсинов в крови. Это физиологическое состояние, связанное с транспортом кровью токсических веществ к органам детоксикации и выведения (элиминации). Токсикоз– патологический синдром, вызванный действием токсинов, сопровождающийся выраженными морфологическими и функциональными изменениями на уровне органов и систем организма
Интоксикация– клиническое проявление патологического состояния, возникшего в результате действия на организм веществ эндогенного или экзогенного происхождения. С биохимической точки зрения эндогенная интоксикация - это метаболический ответ организма на любой агрессивный фактор. Токсические вещества или токсины - это соединения различной природы и химического строения, способные при попадании в организм вызывать заболевания или его гибель. Токсемия – наличие токсинов в крови. Это физиологическое состояние, связанное с транспортом кровью токсических веществ к органам детоксикации и выведения (элиминации). Токсикоз– патологический синдром, вызванный действием токсинов, сопровождающийся выраженными морфологическими и функциональными изменениями на уровне органов и систем организма
 В качестве биохимического субстрата эндогенной интоксикации выступает среднемолекулярный пул веществ, в который входят продукты конечного обмена в высоких концентрациях, продукты промежуточного обмена и продукты изменённого метаболизма.
В качестве биохимического субстрата эндогенной интоксикации выступает среднемолекулярный пул веществ, в который входят продукты конечного обмена в высоких концентрациях, продукты промежуточного обмена и продукты изменённого метаболизма.
 Вещества составляющие среднемолекулярный пул принято разделять на вещества в основном небелкового происхождения и олигопептиды с молекулярной массой 10 -15 к. Д (кило. Дальтон). Среднемолекулярные вещества небелкового происхождения представлены веществами различной природы: 1. мочевина, креатин, мочевая кислота, аминосахара, молочная и другие органические кислоты, аминокислоты, жирные кислоты, билирубин, холестерин, фосфолипиды и их дериваты, продукты промежуточного метаболизма, свободнорадикального окисления, и другие продукты. 2. Высокие концентрации промежуточных метаболитов (аммиак, альдегиды, кетоны); 3. Вещества аномального метаболизма (спирты, карбоновые кислоты) и токсичные компоненты полостных сред организма (фенол, скатол, индол, путресцин, кадаверин).
Вещества составляющие среднемолекулярный пул принято разделять на вещества в основном небелкового происхождения и олигопептиды с молекулярной массой 10 -15 к. Д (кило. Дальтон). Среднемолекулярные вещества небелкового происхождения представлены веществами различной природы: 1. мочевина, креатин, мочевая кислота, аминосахара, молочная и другие органические кислоты, аминокислоты, жирные кислоты, билирубин, холестерин, фосфолипиды и их дериваты, продукты промежуточного метаболизма, свободнорадикального окисления, и другие продукты. 2. Высокие концентрации промежуточных метаболитов (аммиак, альдегиды, кетоны); 3. Вещества аномального метаболизма (спирты, карбоновые кислоты) и токсичные компоненты полостных сред организма (фенол, скатол, индол, путресцин, кадаверин).
 Олиропептидная составляющая среднемолекулярного пула веществ: Регуляторные пептиды – гормоны, играющие важную роль в процессе жизнедеятельности, в обеспечении гомеостаза и патогенезе различных заболеваний. Среди них выявлены нейротензины, нейрокинины, вазоактивный интестинальный пептид, соматостатин, соматомедин, вещество Р, эндорфины, энкефалины и другие биологически активные вещества. Нерегуляторные пептиды – активные в биологическом плане вещества, образующиеся из поступивших из вне токсинов (бактериальные, ожёговые, кишечные) и образовавшиеся внутри организма (за счёт аутолиза, ишемии, гипоксии органов, процессов неорганического протеолиза) продукты, пептиды с нерегулируемым содержанием и непредсказуемыми свойствами.
Олиропептидная составляющая среднемолекулярного пула веществ: Регуляторные пептиды – гормоны, играющие важную роль в процессе жизнедеятельности, в обеспечении гомеостаза и патогенезе различных заболеваний. Среди них выявлены нейротензины, нейрокинины, вазоактивный интестинальный пептид, соматостатин, соматомедин, вещество Р, эндорфины, энкефалины и другие биологически активные вещества. Нерегуляторные пептиды – активные в биологическом плане вещества, образующиеся из поступивших из вне токсинов (бактериальные, ожёговые, кишечные) и образовавшиеся внутри организма (за счёт аутолиза, ишемии, гипоксии органов, процессов неорганического протеолиза) продукты, пептиды с нерегулируемым содержанием и непредсказуемыми свойствами.
 “ Синдром эндогенной интоксикации” - патологическое состояние, в основе которого лежит поражение органов и систем организма, вызываемое накоплением в тканях и биологических жидкостях эндогенных токсинов.
“ Синдром эндогенной интоксикации” - патологическое состояние, в основе которого лежит поражение органов и систем организма, вызываемое накоплением в тканях и биологических жидкостях эндогенных токсинов.
 Эндотоксикоз следует понимать как крайнюю степень синдрома эндогенной интоксикации, вызывающую критическое состояние организма. Критическое состояние организма характеризуется тем, что организм не может самостоятельно компенсировать возникающие расстройства гомеостаза.
Эндотоксикоз следует понимать как крайнюю степень синдрома эндогенной интоксикации, вызывающую критическое состояние организма. Критическое состояние организма характеризуется тем, что организм не может самостоятельно компенсировать возникающие расстройства гомеостаза.
 ЭТИОЛОГИЯ И ПАТОГЕНЕЗ. Пусковой фактор может быть представлен очагом травматической, ишемической или воспалительной деструкции ткани. Синдром эндогенной интоксикации встречается при перитонитах, холециститах, панкреатитах, желтухах, флегмонах, тяжёлых разможжениях тканей(краш-синдром), сахарном диабете, тиреотоксическом зобе и др. , различных отравлениях. Для всех перечисленных заболеваний характерно сочетание токсемии, тканевой гипоксии, угнетение функции собственных детоксицирующих и защитных систем организма.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ. Пусковой фактор может быть представлен очагом травматической, ишемической или воспалительной деструкции ткани. Синдром эндогенной интоксикации встречается при перитонитах, холециститах, панкреатитах, желтухах, флегмонах, тяжёлых разможжениях тканей(краш-синдром), сахарном диабете, тиреотоксическом зобе и др. , различных отравлениях. Для всех перечисленных заболеваний характерно сочетание токсемии, тканевой гипоксии, угнетение функции собственных детоксицирующих и защитных систем организма.
 Тканевая гипоксия приводит к интенсификации перекисного окисления липидов и к анаэробной трансформации гликолиза с образованием лактатов и ацидоза. Интенсификация перекисного окисления липидов происходит в следствии перехода обычного – оксидазного окисления в оксигеназное - в результате которого образуются токсичные вещества: супероксид-анион и перекись водорода. Эти процессы ведут к повреждению всех видов биологических мембран.
Тканевая гипоксия приводит к интенсификации перекисного окисления липидов и к анаэробной трансформации гликолиза с образованием лактатов и ацидоза. Интенсификация перекисного окисления липидов происходит в следствии перехода обычного – оксидазного окисления в оксигеназное - в результате которого образуются токсичные вещества: супероксид-анион и перекись водорода. Эти процессы ведут к повреждению всех видов биологических мембран.
 Молекулы средней массы оказывают ингибирующее действие на ряд метаболических процессов: митохондриальное дыхание, синтез ДНК в альвеолярных макрофагах и лимфоцитах, угнетают процессы внутриклеточной утилизации глюкозы, угнетают синтез гемоглобина, снижают активность ряда клеточных ферментов, обладают сосудосуживающим действием, вызывают гиперосмолярный синдром. Даже незначительное увеличение содержания МСМ может иметь серьёзные последствия для организма и определять тяжесть клинического состояния. Это связано с тем, что МСМ свободно проникают через гематоэнцефалический барьер, нарушая регуляцию вегетативных функций головного мозга и оказывая психо- и нейротропный эффект. Высокие концентрации МСМ угнетают сократительную способность миокарда и выделительную функцию первично не скомпрометированных почек.
Молекулы средней массы оказывают ингибирующее действие на ряд метаболических процессов: митохондриальное дыхание, синтез ДНК в альвеолярных макрофагах и лимфоцитах, угнетают процессы внутриклеточной утилизации глюкозы, угнетают синтез гемоглобина, снижают активность ряда клеточных ферментов, обладают сосудосуживающим действием, вызывают гиперосмолярный синдром. Даже незначительное увеличение содержания МСМ может иметь серьёзные последствия для организма и определять тяжесть клинического состояния. Это связано с тем, что МСМ свободно проникают через гематоэнцефалический барьер, нарушая регуляцию вегетативных функций головного мозга и оказывая психо- и нейротропный эффект. Высокие концентрации МСМ угнетают сократительную способность миокарда и выделительную функцию первично не скомпрометированных почек.
 В 1941 году Каль-Калиф предложил лейкоцитарный индекс интоксикации: Норма 1+ 0, 6. ЛИИ= (4 моноцита + 3 юнные+2 палочкоядерных+сегментоядерные) (пл. кл + 1) (моноциты + лимфоциты) (эозинофилы + 1) Количество нейтрофильного сдвига является основным критерием, характеризующим тяжесть воспалительного процесса и степень интоксикации. Степень сдвига определяется по формуле: М+Ю+П С, где М-миелоциты, Ю – юные, П – палочкоядерные, С- сегментоядерные нейтрофилы. В норме эта величина 0, 05 – 0, 08.
В 1941 году Каль-Калиф предложил лейкоцитарный индекс интоксикации: Норма 1+ 0, 6. ЛИИ= (4 моноцита + 3 юнные+2 палочкоядерных+сегментоядерные) (пл. кл + 1) (моноциты + лимфоциты) (эозинофилы + 1) Количество нейтрофильного сдвига является основным критерием, характеризующим тяжесть воспалительного процесса и степень интоксикации. Степень сдвига определяется по формуле: М+Ю+П С, где М-миелоциты, Ю – юные, П – палочкоядерные, С- сегментоядерные нейтрофилы. В норме эта величина 0, 05 – 0, 08.
 Тяжёлый воспалительный процесс, сопровождающийся выраженной интоксикацией протекает со сдвигом от 1 до 2. Процесс умеренной тяжести со сдвигом 0, 3 – 0, 5. При лёгкой степени-менее 0, 25. При крайней степени тяжести выявляется патологическая зернистость нейтрофилов, вакуолизация цитоплазмы и их ядер, нарушение целостности мембран клеток. Патологическая зернистость определяется задолго до появления палочкоядерного сдвига и является хорошим тестом на определение наличия неспецифического воспаления (Кассирский И. А. 1970).
Тяжёлый воспалительный процесс, сопровождающийся выраженной интоксикацией протекает со сдвигом от 1 до 2. Процесс умеренной тяжести со сдвигом 0, 3 – 0, 5. При лёгкой степени-менее 0, 25. При крайней степени тяжести выявляется патологическая зернистость нейтрофилов, вакуолизация цитоплазмы и их ядер, нарушение целостности мембран клеток. Патологическая зернистость определяется задолго до появления палочкоядерного сдвига и является хорошим тестом на определение наличия неспецифического воспаления (Кассирский И. А. 1970).
 В 1980 -1981 годах Рейс Б. А. с соавторами установили, что наибольшей активностью при гнойно-септическом процессе обладает ряд веществ плазмы, молекулярный вес которых лежит в пределах 1000 – 5000 Дальтон. Было установлено, что вещества средней молекулярной массы играют определённую роль в патогенезе развития почечной и печёночной недостаточности. В 1983 году Габриэлян предложила лабораторный тест по определению содержания средних молекул в плазме. Метод не сложен и даёт вполне реальную ориентировочную картину содержания в плазме токсических веществ. В настоящее время он наиболее часто используется для оценки эндотоксикоза. Норма 0, 24 + 0, 02 у. е.
В 1980 -1981 годах Рейс Б. А. с соавторами установили, что наибольшей активностью при гнойно-септическом процессе обладает ряд веществ плазмы, молекулярный вес которых лежит в пределах 1000 – 5000 Дальтон. Было установлено, что вещества средней молекулярной массы играют определённую роль в патогенезе развития почечной и печёночной недостаточности. В 1983 году Габриэлян предложила лабораторный тест по определению содержания средних молекул в плазме. Метод не сложен и даёт вполне реальную ориентировочную картину содержания в плазме токсических веществ. В настоящее время он наиболее часто используется для оценки эндотоксикоза. Норма 0, 24 + 0, 02 у. е.
 На сегодняшний день показано, что определение концентрации молекул средней массы в плазме позволяет оценить уровень эндогенной интоксикации, исследование сорбционной способности эритроцитов, определение эффективной концентрации альбумина и альбуминовых индексов позволяет оценить уровень системы временного связывания и транспорта токсинов, расчёт лейкоцитарных индексов интоксикации позволяет оценить реакцию организма на синдром эндогенной интоксикации.
На сегодняшний день показано, что определение концентрации молекул средней массы в плазме позволяет оценить уровень эндогенной интоксикации, исследование сорбционной способности эритроцитов, определение эффективной концентрации альбумина и альбуминовых индексов позволяет оценить уровень системы временного связывания и транспорта токсинов, расчёт лейкоцитарных индексов интоксикации позволяет оценить реакцию организма на синдром эндогенной интоксикации.
 Состояние клеточных мембран может отражать степень интоксикации, как показатель влияния мембраноповреждающих факторов на клетку. Высокая степень корреляции изменений свойств мембран эритроцитов и клеточных мембран внутренних органов позволяет использовать биологические мембраны эритроцитов для исследования общих мембранных характеристик.
Состояние клеточных мембран может отражать степень интоксикации, как показатель влияния мембраноповреждающих факторов на клетку. Высокая степень корреляции изменений свойств мембран эритроцитов и клеточных мембран внутренних органов позволяет использовать биологические мембраны эритроцитов для исследования общих мембранных характеристик.
 Пусковой фактор в развитии эндотоксикоза может быть представлен очагом травматической, ишемической или воспалительной деструкции тканей. Установлено, что на начальных этапах развития эндотоксикоза основным механизмом его формирования является продукционно-резорбционный на фоне нестабильности основных систем детоксикации и биотрансформации токсинов. В этот период идёт активное накопление и наработка токсинов с их последующей резорбцией в активный кровоток из очага деструкции. Этот период соответствует стадии токсемии. На этой стадии развития эндотоксикоза не отмечается клинико-лабораторного вовлечения в процесс других органов и систем. Организм больного на этой стадии справляется с токсемией, которая не выходит за рамки гемического спектра.
Пусковой фактор в развитии эндотоксикоза может быть представлен очагом травматической, ишемической или воспалительной деструкции тканей. Установлено, что на начальных этапах развития эндотоксикоза основным механизмом его формирования является продукционно-резорбционный на фоне нестабильности основных систем детоксикации и биотрансформации токсинов. В этот период идёт активное накопление и наработка токсинов с их последующей резорбцией в активный кровоток из очага деструкции. Этот период соответствует стадии токсемии. На этой стадии развития эндотоксикоза не отмечается клинико-лабораторного вовлечения в процесс других органов и систем. Организм больного на этой стадии справляется с токсемией, которая не выходит за рамки гемического спектра.
 Следующая стадия развития эндотоксикоза – стадия напряжения детоксицирующих систем, при которой эндотоксикоз приводит к развитию органопатий. Эта стадия эндотоксикоза характеризуется неспособностью лёгочного барьера защиты справиться с возросшей венозной токсемией. Здесь уже преобладают процессы нарушения выведения и биотрансформации токсинов.
Следующая стадия развития эндотоксикоза – стадия напряжения детоксицирующих систем, при которой эндотоксикоз приводит к развитию органопатий. Эта стадия эндотоксикоза характеризуется неспособностью лёгочного барьера защиты справиться с возросшей венозной токсемией. Здесь уже преобладают процессы нарушения выведения и биотрансформации токсинов.
 Следующая стадия – наиболее грозная – стадия полиорганной недостаточности. Здесь преобладают процессы циркуляторно гипоксические, которые приводят к созданию блока периферической микроциркуляции. Организм как бы старается за счёт централизации гемодинамики и удаления токсинов в интерстиций максимально оградить жизненно важные органы от токсической гематогенной нагрузки.
Следующая стадия – наиболее грозная – стадия полиорганной недостаточности. Здесь преобладают процессы циркуляторно гипоксические, которые приводят к созданию блока периферической микроциркуляции. Организм как бы старается за счёт централизации гемодинамики и удаления токсинов в интерстиций максимально оградить жизненно важные органы от токсической гематогенной нагрузки.
 Оптимальной точкой приложения экстракорпоральной детоксикации, о которой речь пойдёт дальше, является стадия напряжения функциональной системы детоксикации, когда эндотоксикоз как процесс уже вышел за пределы гемического спектра, но ещё не перешёл в стадию полиорганной недостаточности.
Оптимальной точкой приложения экстракорпоральной детоксикации, о которой речь пойдёт дальше, является стадия напряжения функциональной системы детоксикации, когда эндотоксикоз как процесс уже вышел за пределы гемического спектра, но ещё не перешёл в стадию полиорганной недостаточности.
 ЛЕЧЕНИЕ - Хирургическая санация очага инфекции. - Коррекция микроциркуляторных нарушений кровообращения, лимфообращения. Профилактическая и рациональная антибактериальная терапия. - Снижение эндотоксикоза – как профилактика полиорганной и системной недостаточности. - Иммунокоррекция. Энергетическое обеспечение.
ЛЕЧЕНИЕ - Хирургическая санация очага инфекции. - Коррекция микроциркуляторных нарушений кровообращения, лимфообращения. Профилактическая и рациональная антибактериальная терапия. - Снижение эндотоксикоза – как профилактика полиорганной и системной недостаточности. - Иммунокоррекция. Энергетическое обеспечение.
 биологическая трансформация токсических субстанций в печени. В организме эту функцию выполняет моноаминоксидазная система печени, система цитохром Р-450. . В эфферентной терапии этот механизм моделируется такими операциями: непрямое электрохимическое окисление крови, оксигенация крови, перфузия крови через ксеноорганы и клеточные взвеси, фотомодификация крови (лазерное и ультрафиолетовое облучение крови).
биологическая трансформация токсических субстанций в печени. В организме эту функцию выполняет моноаминоксидазная система печени, система цитохром Р-450. . В эфферентной терапии этот механизм моделируется такими операциями: непрямое электрохимическое окисление крови, оксигенация крови, перфузия крови через ксеноорганы и клеточные взвеси, фотомодификация крови (лазерное и ультрафиолетовое облучение крови).
 Разведение и связывание токсических субстанций: В организме это реализуется аутогемодилюцией, функцией иммунной системы. В эфферентной терапии этот механизм моделируется: -гемосорбцией, - плазмосорбция, -лимфосорбция.
Разведение и связывание токсических субстанций: В организме это реализуется аутогемодилюцией, функцией иммунной системы. В эфферентной терапии этот механизм моделируется: -гемосорбцией, - плазмосорбция, -лимфосорбция.
 Элиминация (удаление) токсических субстанций. В организме это реализуется функционированием печени, почек, лёгких, ЖКТ, кожи. В эфферентной терапии этот механизм моделируется: перитонеальным диализом, плазмаферезом, энтеросорбцией, гемодиализом, гемофильтрацией.
Элиминация (удаление) токсических субстанций. В организме это реализуется функционированием печени, почек, лёгких, ЖКТ, кожи. В эфферентной терапии этот механизм моделируется: перитонеальным диализом, плазмаферезом, энтеросорбцией, гемодиализом, гемофильтрацией.
 Показания к методам экстракорпоральной детоксикации высокая токсичность крови в разгар заболевания; отсутствие эффекта от проводимой рутинной дезинтоксикационной терапии в сочетании с обширными тканевыми деструкциями; выраженная интоксикация на фоне непереносимости антибиотиков; быстрое нарастание клиники эндотоксикоза в послеоперационном периоде. -
Показания к методам экстракорпоральной детоксикации высокая токсичность крови в разгар заболевания; отсутствие эффекта от проводимой рутинной дезинтоксикационной терапии в сочетании с обширными тканевыми деструкциями; выраженная интоксикация на фоне непереносимости антибиотиков; быстрое нарастание клиники эндотоксикоза в послеоперационном периоде. -
 Эффекты экстракорпоральной гемокоррекции Обязательным условием проведения экстракорпоральной детоксикации является радикальная санация очага гнойной деструкции. “Синдрома Бартирина” заключается в поступлении токсинов из тканевых депо в центральный кровоток. Для профилактики этого синдрома непосредственно перед перфузией рекомендуется создавать “навязанную токсинемию” в результате улучшения реологических свойств крови, проводить лимфостимуляцию, применять предперфузионную фотомодификацию крови.
Эффекты экстракорпоральной гемокоррекции Обязательным условием проведения экстракорпоральной детоксикации является радикальная санация очага гнойной деструкции. “Синдрома Бартирина” заключается в поступлении токсинов из тканевых депо в центральный кровоток. Для профилактики этого синдрома непосредственно перед перфузией рекомендуется создавать “навязанную токсинемию” в результате улучшения реологических свойств крови, проводить лимфостимуляцию, применять предперфузионную фотомодификацию крови.
 Экстракорпоральная гемокоррекция оказывает комплексное воздействие на организм. Возникающие при этом многообразные эффекты можно разделить на три группы: специфические, неспецифические, дополнительные. Основными специфическими эффектами экстракорпоральной гемокоррекции являются детоксикация, иммунокоррекция, реокоррекция. Неспецифические эффекты экстракорпоральной гемокоррекции определяются контактом с поверхностями магистралей и массообменных устройств. Сюда могут быть отнесены температурные реакции, гемодинамические реакции, вызванные перераспределением жидкости и клеток крови. Дополнительные эффекты связаны с применением во время операции как обязательных, так и специальных медикаментозных средств. Они связаны с применением специальных трансфузионных и медикаментозных программ, проводимых параллельно с экстракорпоральной гемокоррекцией.
Экстракорпоральная гемокоррекция оказывает комплексное воздействие на организм. Возникающие при этом многообразные эффекты можно разделить на три группы: специфические, неспецифические, дополнительные. Основными специфическими эффектами экстракорпоральной гемокоррекции являются детоксикация, иммунокоррекция, реокоррекция. Неспецифические эффекты экстракорпоральной гемокоррекции определяются контактом с поверхностями магистралей и массообменных устройств. Сюда могут быть отнесены температурные реакции, гемодинамические реакции, вызванные перераспределением жидкости и клеток крови. Дополнительные эффекты связаны с применением во время операции как обязательных, так и специальных медикаментозных средств. Они связаны с применением специальных трансфузионных и медикаментозных программ, проводимых параллельно с экстракорпоральной гемокоррекцией.
 По критерию выведения токсинов из организма, эфферентные экстракорпоральные методы разделяются на: неселективные, полуселективные и селективные. Наиболее специфичны в удалении строго определённых субстанций методы иммуносорбции, биоспецифической сорбции крови или её компонентов. Чем менее селективно происходит элиминация компонентов крови, тем больше проявляются неблагоприятные действия данных процедур. К ним относят нарушение электролитного баланса при гемодиализе и плазмаферезе, нарушения гормонального профиля крови(выведение катехоламинов и глюкокортикоидов), - с этим связаны коллаптоидные реакции при плазмаферезе, гипогликемические реакции.
По критерию выведения токсинов из организма, эфферентные экстракорпоральные методы разделяются на: неселективные, полуселективные и селективные. Наиболее специфичны в удалении строго определённых субстанций методы иммуносорбции, биоспецифической сорбции крови или её компонентов. Чем менее селективно происходит элиминация компонентов крови, тем больше проявляются неблагоприятные действия данных процедур. К ним относят нарушение электролитного баланса при гемодиализе и плазмаферезе, нарушения гормонального профиля крови(выведение катехоламинов и глюкокортикоидов), - с этим связаны коллаптоидные реакции при плазмаферезе, гипогликемические реакции.
 Характеристика отдельных методов эфферентной терапии. Гемодиализ – метод прижизненного освобождения крови от низко и среднемолекулярных веществ посредством избирательной диффузии при помощи аппарата “Искуственная почка”. В основе лежит механизм молекулярной диффузии и ультрафильтрации. Происходит диффузионный обмен и фильтрационный перенос низкомолекулярных субстанций и воды через полупроницаемую мембрану из циркулирующей экстракорпорально крови в диализирующий раствор. Корригируется азотемия, нарушения электролитного баланса, нарушения кислотно-щелочного равновесия.
Характеристика отдельных методов эфферентной терапии. Гемодиализ – метод прижизненного освобождения крови от низко и среднемолекулярных веществ посредством избирательной диффузии при помощи аппарата “Искуственная почка”. В основе лежит механизм молекулярной диффузии и ультрафильтрации. Происходит диффузионный обмен и фильтрационный перенос низкомолекулярных субстанций и воды через полупроницаемую мембрану из циркулирующей экстракорпорально крови в диализирующий раствор. Корригируется азотемия, нарушения электролитного баланса, нарушения кислотно-щелочного равновесия.
 Основные показания к применению гемодиализа: терминальная стадия хронической почечной недостаточности; острая почечная недостаточность любого генеза; острые отравления спиртами, техническими жидкостями; гиперкалиемия, азотемия на фоне недостаточности функции почек.
Основные показания к применению гемодиализа: терминальная стадия хронической почечной недостаточности; острая почечная недостаточность любого генеза; острые отравления спиртами, техническими жидкостями; гиперкалиемия, азотемия на фоне недостаточности функции почек.
 Энтеросорбция – метод основанный на детоксикации посредством абсорбции токсинов в кишечнике на эетеросорбенте (производные лигнина – полифепам, энтеросгель). Действие энтеросорбции осуществляется по 2 -м направлениям: -обратный пассаж токсинов из крови в кишечник с дальнейшим связыванием его на сорбентах; -очищение химуса от его токсических продуктов; Гемосорбция – метод экстракорпоральной гемокоррекции, основанный на выведении из крови больного токсических субстанций путём экстракорпоральной перфузии её через сорбент. Показания к этой операции за последнее время значительно сократились в основном потому, что предпочтение отдаётся менее травматичным операциям: плазмаферезу и энтеросорбции. Единственным абсолютным показанием для гемосорбции остаются острые отравления. Объём перфузии при острых эндотоксикозах составляет 1, 5 – 2, 5 ОЦК, при острых экзотоксикозах – 10 -12 ОЦК.
Энтеросорбция – метод основанный на детоксикации посредством абсорбции токсинов в кишечнике на эетеросорбенте (производные лигнина – полифепам, энтеросгель). Действие энтеросорбции осуществляется по 2 -м направлениям: -обратный пассаж токсинов из крови в кишечник с дальнейшим связыванием его на сорбентах; -очищение химуса от его токсических продуктов; Гемосорбция – метод экстракорпоральной гемокоррекции, основанный на выведении из крови больного токсических субстанций путём экстракорпоральной перфузии её через сорбент. Показания к этой операции за последнее время значительно сократились в основном потому, что предпочтение отдаётся менее травматичным операциям: плазмаферезу и энтеросорбции. Единственным абсолютным показанием для гемосорбции остаются острые отравления. Объём перфузии при острых эндотоксикозах составляет 1, 5 – 2, 5 ОЦК, при острых экзотоксикозах – 10 -12 ОЦК.
 Плазмаферез и плазмофильтрация – метод экстракорпоральной гемокоррекции, основанный на замене плазмы крови больного компонентами, препаратами крови или кровезаменителями. Плазмофильтрация - это вариант плазмафереза, при котором для отделения плазмы используют мембранную технологию. В зависимости от объёма удаляемой плазмы метод разделяется на: плазмаферез, при этом удаляется до 70% ОЦП; плазмообмен, - при этом удаляется 70 -150% ОЦП; массивный плазмообмен – при этому удаляется более 150% ОЦП. При плазмаферезе с удалением до 50% ОЦП плазмапотеря может быть восполнена только кристаллоидными растворами в объёме на 50 -100% превышающем эксфузию. При более объёмном плазмаферезе в программу возмещения плазмапотери включаются коллоидные плазмазаменители и кристаллоидные растворы в объёме 70% удалённой плазмы. .
Плазмаферез и плазмофильтрация – метод экстракорпоральной гемокоррекции, основанный на замене плазмы крови больного компонентами, препаратами крови или кровезаменителями. Плазмофильтрация - это вариант плазмафереза, при котором для отделения плазмы используют мембранную технологию. В зависимости от объёма удаляемой плазмы метод разделяется на: плазмаферез, при этом удаляется до 70% ОЦП; плазмообмен, - при этом удаляется 70 -150% ОЦП; массивный плазмообмен – при этому удаляется более 150% ОЦП. При плазмаферезе с удалением до 50% ОЦП плазмапотеря может быть восполнена только кристаллоидными растворами в объёме на 50 -100% превышающем эксфузию. При более объёмном плазмаферезе в программу возмещения плазмапотери включаются коллоидные плазмазаменители и кристаллоидные растворы в объёме 70% удалённой плазмы. .
 Основные показания к проведению плазмафереза: тяжёлые декомпенсированные стадии эндотоксикозов различного генеза; тяжёлые генерализованные формы инфекционных заболеваний; хронические аутоимунные заболевания (бронхиальная астма, системные заболевания соединительной ткани, гематологические заболевания); хронический эндотоксикоз при заболеваниях печени, почек, лёгких; тотальный гемолиз при миолизе при отравлении гемолитическими ядами, синдроме длительного сдавления).
Основные показания к проведению плазмафереза: тяжёлые декомпенсированные стадии эндотоксикозов различного генеза; тяжёлые генерализованные формы инфекционных заболеваний; хронические аутоимунные заболевания (бронхиальная астма, системные заболевания соединительной ткани, гематологические заболевания); хронический эндотоксикоз при заболеваниях печени, почек, лёгких; тотальный гемолиз при миолизе при отравлении гемолитическими ядами, синдроме длительного сдавления).
 Ксеноперфузия – метод экстракорпоральной гемокоррекции, основанный на модификации крови или плазмы при контакте с живыми ксеногенными тканями. Животным – донором, как правило, является свинья Наиболее часто в нашей стране ксеноперфузия осуществляется в варианте плазмоперфузии через взвесь изолированных гепатоцитов. Данная процедура осуществляется в аппарате “искусственная печень”. По мнению отечественных исследователей, абсолютным показанием к этой операции является молниеносная печёночная недостаточность, печёночная кома, декомпенсированный эндотоксикоз при трансплантации печени.
Ксеноперфузия – метод экстракорпоральной гемокоррекции, основанный на модификации крови или плазмы при контакте с живыми ксеногенными тканями. Животным – донором, как правило, является свинья Наиболее часто в нашей стране ксеноперфузия осуществляется в варианте плазмоперфузии через взвесь изолированных гепатоцитов. Данная процедура осуществляется в аппарате “искусственная печень”. По мнению отечественных исследователей, абсолютным показанием к этой операции является молниеносная печёночная недостаточность, печёночная кома, декомпенсированный эндотоксикоз при трансплантации печени.
 После инфузии натрия гипохлорита отмечается восстановление чувствительности к антибиотикам ранее резистентной микробной флоры. Гипохлорит натия обладает также иммуномодулирующим действием, улучшает микроциркуляцию и реологические свойства крови.
После инфузии натрия гипохлорита отмечается восстановление чувствительности к антибиотикам ранее резистентной микробной флоры. Гипохлорит натия обладает также иммуномодулирующим действием, улучшает микроциркуляцию и реологические свойства крови.
 Фотомодификация крови – метод гемокоррекции, основанный на воздействии на кровь вне организма или в сосудистом русле фотонов -квантов оптического излучения ультрафиолетового, видимого и инфракрасного диапазонов, имеющихся в солнечном спектре. Лечебное действие фотомодификации крови обусловлено иммунокоррекцией, улучшением реологических свойств крови, улучшением микроциркуляции, стимуляцией эритропоэза, повышением кислородной ёмкости крови, стимуляцией регенеративных и обменных процессов. Новые возможности фотомодификации крови – это метод фотофореза, используемый в онкологии и гематологии. Суть этого метода заключается во введении больному фотосенсибилизатора (8 метоксипсоралена), который после длинноволнового ультрафиолетового облучения активируется и связывается с ДНК, вызывая при этом повреждение быстроделящихся клеток. Повреждение патологических клеток увеличивает их иммуногенность и вызывает по отношению к ним мощный имунный ответ.
Фотомодификация крови – метод гемокоррекции, основанный на воздействии на кровь вне организма или в сосудистом русле фотонов -квантов оптического излучения ультрафиолетового, видимого и инфракрасного диапазонов, имеющихся в солнечном спектре. Лечебное действие фотомодификации крови обусловлено иммунокоррекцией, улучшением реологических свойств крови, улучшением микроциркуляции, стимуляцией эритропоэза, повышением кислородной ёмкости крови, стимуляцией регенеративных и обменных процессов. Новые возможности фотомодификации крови – это метод фотофореза, используемый в онкологии и гематологии. Суть этого метода заключается во введении больному фотосенсибилизатора (8 метоксипсоралена), который после длинноволнового ультрафиолетового облучения активируется и связывается с ДНК, вызывая при этом повреждение быстроделящихся клеток. Повреждение патологических клеток увеличивает их иммуногенность и вызывает по отношению к ним мощный имунный ответ.
 Эфферентная терапия – это непрерывно развивающаяся отрасль медицины и мы ещё узнаем много интересного о её достижениях.
Эфферентная терапия – это непрерывно развивающаяся отрасль медицины и мы ещё узнаем много интересного о её достижениях.

Развитие интенсивной терапии и реанимации, расширив пределы оживления, обнаружило ряд нерешенных проблем. Одной из них следует считать проблему эндогенной интоксикации (ЭИ).
Современное представление об ЭИ связано, в первую очередь, с понятием полиорганной недостаточности или множественной недостаточности органов, или синдромом 80-летних, или MOF-синдромом. При этом подразумевается одномоментное или последовательное наступление несостоятельности сердца, легких, печени, почек, мозга, что приводит к высокой летальности -- от 60 до 80% и более. Причем летальность находится в прямой зависимости от числа органов, вовлеченных в этот синдром.
Следует отметить, что среди составляющих синдрома полиорганных нарушений (СПОН) традиционно приоритетное значение отводится нарушению кровообращения и дыхания, которые развиваются соответственно в 60% и 65% случаев. Однако при этом считается достоверно установленным фактом, что в исходе синдрома мультиорганных поражений существенную роль играют несостоятельность печени, почек, пищеварительного тракта, сопровождающие СПОН соответственно в 60%, 56% и 53% случаев. Таким образом, несостоятельность метаболического гомеостаза вследствие печеночно-почечной недостаточности встречается так же часто, как и сердечно-легочная недостаточность. Однако клиническая картина нарушений метаболизма не проявляется так ярко, как нарушения дыхания и кровообращения, особенно на ранних этапах своего развития. Поэтому диагностика нарушенного метаболизма, как правило, опаздывает за событиями развивающихся процессов. Это приводит к констатации фактов при далеко зашедших или уже необратимых изменениях, определяющих исход заболеваний.
ЭИ можно определить как неспецифический по большинству клинико-биохимических и иммунологических проявлений синдром несоответствия между образованием и выведением как продуктов «нормального» обмена, так и веществ нарушенного метаболизма.
Сущность ЭИ базируется на концепции представления ее как отражения последствий нарушения макроциркуляции и микрогемолимфоциркуляции, газообмена и кислородного бюджета, иммунитета и противоинфекционной «защиты» при несостоятельности управления интеграцией этих процессов. При этом расстройства метаболизма протекают в соответствии с характером повреждающего фактора и ответной реакцией на него системы макро- и микроциркуляции в соответствии с нарушением транспорта и экстракцией тканями кислорода, активацией симпатико-адреналовой системы. Это приводит к типичному для критического состояния синдрому гиперметаболизма -- потребности тканей в различных субстратах обеспечения компенсаторно-приспособительных механизмов сохранения энергии, предотвращения распада белков, снижения утилизации жирных кислот, увеличения глюконеогенеза и толерантности к глюкозе, интенсификации проницаемости эндотелия.
В зависимости от преобладания механизма формирования ЭИ условно выделяют такие ее формы: ретенционную, обменную, резорбционную,сепсис.смешанная.
Ретенционный механизм предусматривает преимущественно нарушение естественного механизма удаления, как правило, конечных продуктов метаболизма низкомолекулярных соединений (размер молекул -- менее 10 нм, молекулярная масса [ММ] -- менее 500 дальтон). Основным путем их элиминации является почечная фильтрация и экскреция.
Обменный механизм характеризуется накоплением промежуточных продуктов метаболизма (размер молекул -- более 10 нм, ММ -- менее 500 дальтон), элиминация которых осуществляется печенью и через пищевой канал.
интоксикация эндогенный маркер
Резорбционная ЭИ сопровождается накоплением токсинов с ММ более 500 дальтон и размером молекул более 200 нм вследствие всасывания продуктов разрушения тканей и клеток.
Инфекционный компонент ЭИ обусловлен микробными токсинами, включающими молекулы до 200 нм с ММ до 500 дальтон.
Таким образом, перечень веществ аутоинтоксикации может составлять десятки наименований, а уровень их «токсической» концентрации может быть увеличен в сотни тысяч раз.
Условно можно выделить 5 классов эндотоксинов: 1)вещества нормального метаболизма в нефизиологических концентрациях (мочевина, лактат, глюкоза, креатинин, билирубин и др.);2) продукты нарушенного метаболизма (альдегиды, кетоны, кислоты);3) иммунологически чужеродные вещества (глико- и липопротеиды, фосфолипиды); 4)ферменты;5) медиаторы воспаления, в том числе цитокины, биогенные амины, антитела, циркулирующие иммунные комплексы, молекулы адгезии, продукты деградации белков и другие.
В связи с этим определение сущности ЭИ требует учета состояния естественной детоксикации, включающей три взаимосвязанных системы: монооксигеназную, иммунную, выделительную.
Деятельность монооксигеназной системы микросомального окисления и иммунитета сопряжены и функционально скоординированы для обеспечения распознавания токсинов с последующей их сорбцией и экскрецией печенью, почками, кожей, легкими, селезенкой, пищеварительным трактом. При этом различия монооксигеназной и иммунной систем определяются распознаванием токсинов-мишеней: микросомальная система метаболизирует свободные ксенобиотики и низкомолекулярные вещества, а прерогативой иммунной системы (макрофагально-лимфоцитарного комплекса) является распознавание и нейтрализация соединений, конъюгированных с макромолекулярным носителем. Сущность этих процессов объясняют: теория неинфекционного иммунитета, включающая представления об иммунологической толерантности (P. Medawar и соавт., Нобелевская премия по иммунологии, 1953), иммунологическом надзоре за генетическим постоянством целостности организма (F. Bwenet, Нобелевская премия по иммунологии, 1960); теория естественного иммунитета к низкомолекулярным соединениям (И.Е. Ковалев, 1970), открытие цитокин-обусловленной сигнальной системы при иммунном ответе, гемопоэзе, воспалении. Эти теории определяют роль иммунных механизмов в обеспечении «химического» гомеостаза, а иммунная система рассматривается как неотъемлемая составная часть системы детоксикации, распознающая и нейтрализующая макромолекулы соединений, конъюгированных с макромолекулярным носителем.
При этом становится понятным, что нарушение взаимосвязи между монооксигеназной и иммунной системами определяет несоответствие скорости образования и устранения как патологических, так и физиологических продуктов метаболизма в жидкостных секторах и тканях.
Черты сходства в реакции на токсины прослеживаются в характере иммунной и микросомальной систем. И в первой, и во второй системе происходит индукция специфических белков, обеспечивающих связывание и метаболизм молекулы индикатора. Память на ксенобиотики, метаболизируемые монооксигеназной системой, похожа на иммунную память: повторные введения низкомолекулярного ксенобиотика мощнее, чем в первый раз, активируя ферменты монооксигеназной системы, подобно тому, как высота иммунного ответа возрастает при повторном введении антигена.
Различные ксенобиотики при взаимодействии с оксидазами конкурируют за места связывания, а антигены конкурируют в индукции синтеза антител.
Кроме того, многочисленные низкомолекулярные соединения способны индуцировать иммунную реакцию, а иммуноциты -- продуцировать иммуноглобулины. Клетки печени, метаболизирующие ксенобиотики, синтезируют альбумин -- основной белок плазматической детоксикации, напоминающий иммуноглобулины, но с более низкой специфичностью.
Эти факты являются свидетельством того, что микросомальное окисление и иммунитет -- равнозначные составляющие системы детоксикации -- обеспечивают соответствующее звено метаболического гомеостаза.
При этом нарушение взаимосвязи в системе между монооксигеназным и иммунным звеном проявляется несоответствием между скоростью накопления как патологических, так и физиологических метаболитов по их биотрансформации и выведению. Это приводит к накапливанию в тканях и жидкостных секторах патологических продуктов клеточного распада, эндотоксинов, пирогенов, биологически активных веществ различных типов, нейромедиаторов, свободных радикалов и прочих продуктов.
Результатом этого являются два процесса воздействия на клетки монооксигеназной системы и иммунитета: разобщение окислительно-восстановительного фосфорилирования, что приводит либо к гибели клетки, либо к снижению ее функциональной активности, а также, возможно, и прямое токсическое повреждение структур клеток. Следствием этого является, с одной стороны, нарушение биохимического состава клеток, тканей, в том числе клеток крови; с другой -- нарушение антителопродукции, лимфоцитотоксичности, нарушение синтеза медиаторов ответа.
Следовательно, ЭИ развивается или как результат разбалансировки составляющих систему детоксикации, или при несостоятельности одного из звеньев, или одновременно всех ее составляющих. Это определяет сущность ЭИ, ее общие и отличительные черты в зависимости от основной причины, т.е. этиологии заболевания, а также степень ее тяжести соответственно числу органов и составных частей детоксикации, вовлеченных в патологический процесс (рис. 1).
Наряду с этим следует особо отметить место микробного фактора в структуре эндогенной интоксикации при критическом состоянии любого генеза. Микробный фактор составляет один из так называемых парадоксов критического состояния:
- * бактериемия рано или поздно всегда сопровождает критическое состояние;
- * лечение инфекции не увеличивает выживаемости;
- * пусковой механизм полиорганной недостаточности (ПОН) -- не обязательно инфекция.
Роль микробного фактора трансформируется, прежде всего, в связи с выделением эндотоксинов и/или экзотоксинов, молекулы которых могут имитировать структуры ферментов, гормонов, нейромедиаторов, нарушая физиологические обменные процессы.
Так, экзотоксин является секретом живого микроорганизма, представляет собой термолабильные белки, обладающие высокой иммуногенностью, нарушающие внутриклеточные обменные процессы путем фермент-необратимой трансформации A5ДФ; литические ферменты повреждают цитоплазматическую мембрану, блокируют синаптическую передачу мотонейронов благодаря ингибированию нейротрансмиттеров (рис. 2, 3).


Эндотоксин представляет собой сложный комплекс оболочки микроорганизма с активной субстанцией -- липосахарид LPS, липид А. Этот токсин термолабилен, у него отсутствует иммуногенность, главные точки его приложения -- клетки эндотелия и иммунного реагирования. В результате воздействия на моноциты/макрофаги эндотоксин обеспечивает высвобождение биологически активных веществ: интерлейкинов, лейкотриенов, простагландинов, TNF-, метаболитов кислорода, фактора активации тромбоцитов, серотонина, фактора Виллебранда, оксида азота, фактора Хагемана, лизосомальных ферментов (рис. 2, 3).
Липосахаридная субстанция является составной частью токсина мембраны грамотрицательных микроорганизмов. Грамположительные микробы являются источником ряда токсинов, включая токсин-1, пирогенный эндотоксин, L-токсин, О-стрептолизин, L-гемолизин, лимфотоксин, токсин шока, тейхионовые кислоты (рис. 4).

Оценивая роль эндотоксинов микробного происхождения в развитии синдрома ЭИ, следует учитывать тот факт, что в физиологических условиях грамотрицательные микробы населяют поверхность кожи и слизистой оболочки, являясь источником эндотоксина, который в «физиологической» концентрации 0,001 мг/кг стимулирует полиморфноядерные лейкоциты, макрофаги, другие клетки иммунной естественной защиты, систему коагуляции, миелопоэз. Однако при повышении концентрации эндотоксина в связи с несостоятельностью антиэндотоксинового иммунитета формируется ЭИ.
Таким образом, ЭИ как составная часть критического состояния любого происхождения развивается вследствие несостоятельности основных составляющих систем детоксикации: монооксигеназной, выделительной и иммунной -- по утилизации и устранению как продуктов нормального и нарушенного метаболизма, так и токсинов микроорганизмов.
Условно показатели, отражающие состояние системы детоксикации, можно разделить на:
- * биохимические маркеры ЭИ;
- * иммунологические маркеры ЭИ;
- * интегральные маркеры ЭИ.
> Интоксикация организма
Данная информация не может использоваться при самолечении!
Обязательно необходима консультация со специалистом!
Что такое интоксикация?
Интоксикация организма - патологическое состояние, вызванное негативным воздействием различных токсических веществ, которые могут попасть в организм извне либо образоваться в нем самом вследствие развития отдельных заболеваний. В зависимости от того, каким путем яд проник в организм, выделяют экзогенную и эндогенную интоксикации.
Экзогенное отравление
Экзогенную интоксикацию еще называют общим отравлением. Данное состояние возникает и развивается при попадании в организм человека ядов и токсических веществ: мышьяка, селена, бериллия, тяжелых металлов, фтора, хлора, йода. Отравляющим веществом могут быть токсины ядовитых растений, микроорганизмов или животных. Яд может проникать в организм через кожу, слизистые, через пищеварительный тракт и дыхательные пути. Иногда причиной общего отравления выступает не само ядовитое веществ, а продукты его преобразования. Чаще всего встречается экзогенная интоксикация, причиной которой является передозировка алкоголя или наркотиков.
Эндогенная интоксикация
Эндогенная интоксикация обозначается терминами «эндотоксикоз», «аутоинтоксикация». Это состояние развивается вследствие нарушения выведения продуктов обмена из организма при некоторых заболеваниях. Эндогенная интоксикация всегда наблюдается при злокачественных новообразованиях, инфекционных болезнях, при нарушении работы почек и кишечника. Самоотравление может развиться, если в организме вырабатываются в избыточном количестве и накапливаются биологически активные вещества (гормоны щитовидной железы, адреналин и пр.). Эндогенной интоксикацией сопровождаются ожоги и серьезные травмы различного происхождения. Эндотоксикоз имеет место при ревматоидном артрите, остром панкреатите, сепсисе и другой патологии.
Клинические проявления
Клинические проявления интоксикации достаточно широки. Все зависит от характера и концентрации токсического вещества, а также от степени отравления. Острая интоксикация проявляется следующими симптомами: высокая температура, сильная боль в суставах и мышцах, рвота, понос. Если токсины очень ядовиты, возможны потеря сознания и даже кома.
О состоянии подострой интоксикации говорят субфебрильная температура (до 38 градусов), головная и мышечная боли, нарушения работы органов желудочно-кишечного тракта, сонливость и постоянное чувство усталости.
Хроническая интоксикация развивается как результат недолеченного до конца острого отравления либо при нарушении выведения из организма продуктов обмена и характеризуется такими симптомами: раздражительность, депрессивные состояния, бессонница, общая слабость, хронические головные боли, изменение веса, серьезные проблемы со стороны ЖКТ (метеоризм, поносы, запоры).
Интоксикация в большинстве случаев негативно отражается на состоянии иммунитета и кожных покровов. Появляется неприятный запах тела, возникают различные кожные болезни (дерматит, фурункулез, угревая сыпь), проявляются аллергические реакции, значительно понижается устойчивость организма к вирусам и бактериям, иногда развиваются аутоиммунные патологии.
Лечение интоксикации
При лечении интоксикации основные усилия направлены на обезвреживание ядовитых веществ посредством применения антидотов (вазелиновое масло, активированный уголь, гипохлорит натрия, перманганат калия) или антитоксических сывороток. Следующий шаг - ускорение выведения токсинов из организма (промывание полостей, обильное питье, применение слабительных и мочегонных лекарственных средств, кислородная терапия, переливание кровезаменителей). В любом случае правильное лечение может назначить только опытный доктор, поэтому при первых же симптомах отравления необходимо обращаться за помощью без промедления. Самолечение опасно для здоровья, а иногда и для жизни человека.
Понятие об эндогенной интоксикации.
Основные виды эндотоксикоза у хирургических больных
Общеклинические и лабораторные признаки эндотоксикоза
Критерии тяжести эндогенной интоксикации в хирургической клинике.
Принципы лечения эндотоксикоза
Устранение тканевой гипоксии
Искусственное удаление токсичных продуктов из организма
Основные методы экстракорпоральной детоксикации.
Понятие об эндогенной интоксикации.
Под синдромом эндогенной интоксикации (СЭИ) понимают комплекс симптомов, обусловленных накоплением в тканях и биологических жидкостях эндотоксинов.
Эндотоксикоз – накопление токсичных метаболитов в высоких концентрациях в тканях и биологических жидкостях (кровь, лимфа, цереброспинальная жидкость).
Эндотоксемия – это накопление токсичных метаболитов в крови.
Основные виды эндотоксикоза у хирургических больных
Травматический эндотоксикоз – возникает при освобождении тела от сдавления и всасывания в кровь пострадавшего продуктов аутолиза размозженных тканей.
Ишемический эндотоксикоз – нарушения доставки к тканям кислорода, субстратов окисления, удаления продуктов тканевого метаболизма.
Инфекционно-воспалительный эндотоксикоз – формирование местного инфекционно-воспалительного очага как главного источника эндогенной интоксикации.
Метаболический эндотоксикоз – на фоне высокой активности источника образования токсичных веществ собственные природные механизмы детоксикации оказываются несовершенными.
Дисгормональный эндотоксикоз – повышенный выброс гормонов патологически измененными органами внутренней секреции.
Общеклинические и лабораторные признаки эндотоксикоза
Клиническая оценка эндотоксикоза:
ЦНС – возбуждение или угнетение сознания. Выявление патологии ЦНС не требует каких-либо специальных методов.
При тяжелых степенях эндотоксикоза у больных глубокая психическая оглушенность (сопор или коматозное состояние).
При менее тяжелой интоксикации у больных оглушение, делирий, сумеречное помрачение сознания.
Гемодинамические нарушения
Тахикардия при отсутствии кровопотери, тяжелого нарушения внешнего дыхания - один из признаков эндогенной интоксикации.
При тахикардии 120 в мин. и более тахикардия сопровождается снижением АД. Тоны сердца приглушены, на ЭКГ диффузные мышечные изменения. Затем развиваются нарушения микроциркуляции: бледность и мраморность кожных покровов.
Нарушения в системе внешнего дыхания
При отсутствии травмы груди или массивной пневмонии, как следствие развивающейся гипоксии тканей, развивается острая дыхательная недостаточность. Легкие – один из первых органов мишеней, подвергающихся повреждению.
Нарушения микроциркуляции
Повышение содержания в крови биологически активных веществ, влияющих на тонус и проницаемость сосудов (гистамин).
Увеличение содержания веществ, повреждающих и нарушающих синтез легочного сурфактанта (эндотоксины, молекулы средней массы, продукты перекисного окисления липидов).
Острая дыхательная недостаточность проявляется в одышке и снижении сатурации.
Острая печеночно-почечная недостаточность – чаще следствие нарушений микроциркуляции.
Водно-электролитные нарушения
Проявления дегидратации (сухость и снижение тургора кожных покровов, исчезновение рельефа подкожных вен, западение глазных яблок, жажда, сухость языка).
Потери воды (перитонит, острая кишечная непроходимость, инфекционно-воспалительные процессы другой локализации, сопровождающиеся экссудацией и гипертермией)
Другие виды эндотоксикоза у хирургических больных (стимуляция естественных механизмов детоксикации: эндогенная гемодилюция и интерстициальный отек в зоне воспалительного процесса)
Нарушения терморегуляции
Гипертермия, при критическом состоянии гипотермия
Снижение моторики ЖКТ
Лабораторная оценка эндотоксикоза:
Лейкоцитоз, сдвиг лейкоцитарной формулы влево, токсическая зернистость нейтрофилов
При тяжелом течении эндотоксикоза в периферической крови нарастает лейкоцитоз с тенденцией к очень высоким цифрам – 25-30∙10 9 . Лейкоцитарная формула изменяется за счет увеличения количества нейтрофилов (палочкоядерных и миелоцитов). Такое изменение лейкоцитарной формулы носит название сдвига влево. Нейтрофилез свидетельствует об активности воспалительного процесса, эозинофилия – об относительной недостаточности функции надпочечников, лимфопения – о состоянии иммунной депрессии.
Ускорение СОЭ
Уменьшение содержания общего белка крови
Гиперферментемия (увеличение содержания в крови АлТ, и АсТ)
Увеличение содержания билирубина в крови
Гиперазотемия (увеличение содержания в крови мочевины и креатинина)
Снижение показателей клеточного и гуморального иммунитета.
Маркеры эндотоксемии:
Средние молекулы (СМ, у.е), норма до 0,2 у.е.
К средним молекулам относят лизосомальные ферменты, продукты протеолиза и олигопептиды. Основным источником их образования считается усиление катаболизма и неферментного протеолиза, в том числе и белков крови. Они угнетают эритропоэз, тормозят глюконеогенез и синтез ДНК, оказывают цитотоксическое действие, вызывают нарушения микроциркуляции.
Лейкоцитарный индекс интоксикации (ЛИИ, у.е.), норма 1,0-1,4
ЛИИ по Кальф-Калифу:
ЛИИ=(4 мон+3 юн + 2 пал + сегм)×(плазм + 1) / (мон + лимф) × (эоз + 1)
Плазматические клетки в небольшом количестве могут появляться при любом инфекционно-воспалительном процессе, при злокачественных новообразованиях.
Протеолитическая активность сыворотки крови (ПА, мин.), норма до 4
Циркулирующие иммунные комплексы (ЦИК, ед), норма до 40
Перекисное окисление липидов (ПОЛ), увеличение.